Iridium
| Iridium | |||
|---|---|---|---|
 | |||
| Basisdata | |||
| Navn | Iridium | ||
| Symbol | Ir | ||
| Atomnummer | 77 | ||
| Utseende | sølvhvit | ||
| Plass i periodesystemet | |||
| Gruppe | 9 | ||
| Periode | 6 | ||
| Blokk | d | ||
| Kjemisk serie | transisjonsmetall | ||
| Atomegenskaper | |||
| Atomvekt | 192,217 u | ||
| Empirisk atomradius | 135 pm | ||
| Kalkulert atomradius | 180 pm | ||
| Kovalent atomradius | 137 pm | ||
| Elektronkonfigurasjon | [Xe] 4f14 5d7 6s2 | ||
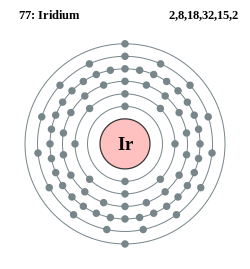
| Elektroner per energinivå | 2, 8, 18, 32, 15, 2 | ||
| Oksidasjonstilstander | -1, 0, 1, 2, 3, 4, 6 | ||
| Krystallstruktur | kubisk flatsentrert | ||
| Fysiske egenskaper | |||
| Stofftilstand | fast stoff | ||
| Smeltepunkt | 2 446 °C | ||
| Kokepunkt | 4 428 °C | ||
| Molart volum | 8,52 · 10-6 m³/mol | ||
| Tetthet | 22 560 kg/m³ | ||
| Hardhet | 6,5 (Mohs skala) | ||
| Fordampningsvarme | 604 kJ/mol | ||
| Smeltevarme | 26,1 kJ/mol | ||
| Damptrykk | 1,47 Pa ved 2 716 K | ||
| Lydfart | 4 825 m/s | ||
| Diverse | |||
| Elektronegativitet etter Pauling-skalaen | 2,2 | ||
| Spesifikk varmekapasitet | 130 J/(kg · K) | ||
| Elektrisk ledningsevne | 19,7 · 106 S/m | ||
| Termisk konduktivitet | 147 W/(m · K) | ||
Iridium er et metallisk grunnstoff med kjemisk symbol Ir og atomnummer 77. Atommassen (u) er 192,2.
Historie[rediger | rediger kilde]
Iridium ble oppdaget i 1803 av den engelske kjemikeren Smithson Tennant i London. Han forsøkte sammen med William Hyde Wollaston å finne en fremgangsmåte for å fremstille rent platina ved å løse opp platina-malm i kongevann. Et biprodukt av prosessen var et svart pulver som ikke løste seg opp. Tennant konsentrerte seg om det uoppløste pulveret, og i 1803 identifiserte han 2 nye grunnstoff, nemlig osmium og iridium. Funnet ble dokumentert i et brev til the Royal Society i juni 1804.
Tennant døpte det nye grunnstoffet iridium etter gresk ίρις, iris – «regnbue», på grunn av stoffets fargerike salter.
Egenskaper[rediger | rediger kilde]
Iridium er et hardt sølvhvitt transisjonsmetall, og er det mest korrosjonsbestandige av de kjente grunnstoffene. Det angripes ikke av noen syrer, ikke en gang kongevann, men løses opp av flytende salter. Hvis iridium glødes oksiderer det og danner svartfarget IrO2. På grunn av sin hardhet og sprøhet er det vanskelig å forme og maskinere rent iridium. Ved temperaturer under 0,11 K blir iridium superledende.
Iridium er regnet som det nest tyngste grunnstoffet etter osmium, men isotopen 193Ir er den tyngste av alle kjente stabile isotoper med 22 650 kg/m³. Hvilket grunnstoff som har høyest tetthet er derfor et spørsmål om definisjon, selv om osmium med 22 610 kg/m³ generelt regnes som det tyngste.
Isotoper[rediger | rediger kilde]
Naturlig forekommende iridium består av 2 stabile isotoper: 191Ir (37,3 %) og 193Ir (62,7 %). I tillegg finnes 34 kunstig fremstilte ustabile (og dermed radioaktive) isotoper, hvorav de mest stabile er 192m2Ir med halveringstid 241 år, 194m2Ir med halveringstid 171 døgn og 192Ir med halveringstid 73,83 døgn.[1]
CAS-nummer: 7439-88-5
Forekomst[rediger | rediger kilde]

Iridium er sjeldnere enn både gull og platina, og forekommer naturlig i ren form som små korn i platina-malm og elvesand. Sammen med osmium danner det to mineraler: osmiridium, hvor halvparten består iridium, og resten består av osmium, platina, ruthenium og rhodium, og iridosmium som består av 55-80 % osmium og 20-45 % iridium. Iridium finnes ofte i meteoritter. Iridium er også et biprodukt av nikkelfremstilling.
De viktigste forekomstene ligger i Sør-Afrika, Ural i Russland, Nord- og Sør-Amerika, Borneo og Japan.
Iridium er 20 000 ganger mer vanlig i verdensrommet enn i jordskorpen – trolig fordi mesteparten av det som fantes på Jorden, sank innover i kjernen da planeten var ung.[2]
Anvendelse[rediger | rediger kilde]
Iridium brukes i blant annet kirurgiske instrumenter, tennrør og elektroder. Det inngår i legeringer med osmium. Isotopen 192Ir er radioaktiv og benyttes som kilde ved strålebehandling av kreft.
Se også[rediger | rediger kilde]
Referanser[rediger | rediger kilde]
- ^ Lawrence Berkeley National Laboratory – Isotoptabell for iridium Arkivert 11. mai 2008 hos Wayback Machine.
- ^ Bill Bryson: En kort historie om nesten alt, forlaget Gyldendal, Oslo 2005, ISBN 82-05-33391-2
