Karbondioksid: Forskjell mellom sideversjoner
Legger til arbeid pågår for å marker at artikkelen fra tysk WP er under oversettning. |
Opprettet en ny og utvidet artikkel basert på tysk Wikipedia. |
||
| Linje 1: | Linje 1: | ||
{{Infoboks kjemiskstoff |
|||
{{Arbeid pågår}} |
|||
| navn = |
|||
| overtekst = Karbondioksid |
|||
| undertekst = |
|||
| infoboksklasse = |
|||
| infoboksstørrelse = |
|||
| bildesjekk = |
|||
| bilde = Carbon-dioxide-2D-dimensions.svg |
|||
| bildestørrelse = |
|||
| bildetekst = Strukturformel til karbondioksid med båndlengde |
|||
| bildesjekk1 = |
|||
| bilde1 = |
|||
| bildestørrelse1 = |
|||
| bildetekst1 = |
|||
| bildesjekk2 = |
|||
| bilde2 = |
|||
| bildestørrelse2 = |
|||
| bildetekst2 = |
|||
| bildesjekk3 = |
|||
| bilde3 = |
|||
| bildestørrelse3 = |
|||
| bildetekst3 = |
|||
| dobbeltbildesjekk1 = |
|||
| dbilde1 = Carbon dioxide 3D ball.png |
|||
| dbilde2 = Carbon dioxide 3D spacefill.png |
|||
| dbildetekst1 = |
|||
| dbildetekst2 = |
|||
| dobbeltbildesjekk2 = |
|||
| dbilde3 = |
|||
| dbilde4 = |
|||
| dbildetekst3 = |
|||
| dbildetekst4 = |
|||
| IUPAC_navn = |
|||
| type = |
|||
| FIN = |
|||
| systematisk navn = |
|||
| andre navn = [[Tørris]] |
|||
| forkortelser = |
|||
| CAS-nummer = 124-38-9 |
|||
| PubChem = |
|||
| ChemSpider = 274 |
|||
| EINECS = 204-696-9 |
|||
| EU-nummer = |
|||
| EINECSCASNO = |
|||
| UN-nummer = 1013 (gass), 1845 (fast) |
|||
| DrugBank = |
|||
| KEGG = D00004 |
|||
| MeSH = Karbon+dioksid |
|||
| ChEBI = 16526 |
|||
| RTECS = FF6400000 |
|||
| ATCvet = -- |
|||
| SMILES = O=C=O |
|||
| InChI = |
|||
| InChI1 = |
|||
| InChI2 = |
|||
| InChI3 = |
|||
| InChI4 = |
|||
| InChIKey = |
|||
| InChIKey1 = |
|||
| InChIKey2 = |
|||
| InChIKey3 = |
|||
| InChIKey4 = |
|||
| Beilstein = |
|||
| UNII = |
|||
| UNII1 = |
|||
| UNII2 = |
|||
| UNII3 = |
|||
| UNII4 = |
|||
| UNII5 = |
|||
| Gmelin = 989 |
|||
| 3DMet = B01131 |
|||
| kjemiskformel = CO<sub>2</sub> |
|||
| ladning = |
|||
| molvekt = 44,01 g/[[mol]] |
|||
| utseende = Fargeløs gass |
|||
| tetthet = 1,977 <small>(gass ved1 atm og 0 °C)</small> |
|||
| smeltepunkt = ikke ved normalt trykk |
|||
| kokepunkt = ikke ved normalt trykk |
|||
| logP = |
|||
| damptrykk = 5,73 [[Mpa]] ved 20 °C |
|||
| henrykonstant = |
|||
| atmosohratekonstant = |
|||
| sublimasjon = −78,5 °C; 194,7 K (1 atm) |
|||
| løselighet = 1,45 g/l ved 25 °C, 100 kPa |
|||
| Ksp = |
|||
| Ksp-av = |
|||
| løselighet1 = |
|||
| løsningmiddel1 = |
|||
| pKa = 6,35, 10,33 |
|||
| Ka = |
|||
| pKb = |
|||
| K = |
|||
| IEP = |
|||
| LambdaMax = |
|||
| absorpsjon = |
|||
| energigap = |
|||
| elektronmobilitet = |
|||
| spesrotasjon = |
|||
| MagSus = -20,5·10<sup>−6</sup> cm<sup>3</sup>/mol |
|||
| termiskkond = |
|||
| brytningsindeks = 1,0004493 (0 °C, 101,325 kPa) |
|||
| viskositet = 0,07 [[Poise|cP]] ved −78,5 °C |
|||
| rhcrit = |
|||
| dipol = 0D |
|||
| gjennomsnittligporestørrelse = |
|||
| porevolum = |
|||
| spesoverflateareal = |
|||
| krystallstruktur = trigonal |
|||
| krystallgruppe = |
|||
| lattkonstant a = |
|||
| lattkonstant b = |
|||
| lattkonstant c = |
|||
| lattkonstant alpha = |
|||
| lattkonstant beta = |
|||
| lattkonstant gamma = |
|||
| koordinasjon = |
|||
| molekylform = Lineært |
|||
| hybridisering = |
|||
| deltahf = −393,5 kJ·mol<sup>−1</sup> |
|||
| deltahc = |
|||
| entropi = 214 J·mol<sup>−1</sup>·K<sup>−1</sup> |
|||
| varmekapasitet = 37,135 J/K mol |
|||
| proteinbundet = |
|||
| biotilgjengelighet = |
|||
| stoffskifte = |
|||
| metabolitt = |
|||
| biologiskhalveringstid = |
|||
| ekskresjon = |
|||
| gravkat = |
|||
| gravkatUK = |
|||
| gravkatUSA = |
|||
| gravkatAU = |
|||
| gravkatCA = |
|||
| rettslig = |
|||
| rettsligUK = |
|||
| rettsligUSA = |
|||
| rettsligAU = |
|||
| rettsligCA = |
|||
| adminrute = |
|||
| lisensEU = |
|||
| lisensUSA = |
|||
| avhengighetsrisiko = |
|||
| slagfølsomhet = |
|||
| friksjonsfølsomhet = |
|||
| detonasjonshastighet = |
|||
| refaktor = |
|||
| eksternsikkblad = [https://app.ecoonline.com/ecosuite/showpage.php?objID=-1&applicationID=7&viewForm=htmlext&viewPage=showmsds&accessKey=jku6vDL4SKc7zK9JPD7YFWIbBKtIJeyMr3rGT1lkKSgw/hQvJfpLWVwTkACPBSmf&msdsLang=1 EcoOnline ] |
|||
| euklass = |
|||
| EUindeks = |
|||
| hovedfarer = |
|||
| NFPAH = 1 |
|||
| NFPAF = 0 |
|||
| NFPA-R = 0 |
|||
| NFPA-O = |
|||
| rsetninger = |
|||
| ssetninger = |
|||
| rssetninger = |
|||
| flammepunkt = |
|||
| tenntemp = |
|||
| eksplogrense = |
|||
| ld50 = |
|||
| hudfare = |
|||
| øynefare = |
|||
| innåndingsfare = |
|||
| svelgingfare = |
|||
| GHSPpiktogram = {{GHS-Piktogramme|04}} |
|||
| ghssignalord = |
|||
| hpsetninger = |
|||
| psetninger = |
|||
| tgv = |
|||
| pel = TWA 5000 ppm (9000 mg/m<sup>3</sup> |
|||
| andreanioner = [[Karbondisulfid]]<br/> [[Karbondisulfid ]] |
|||
| andrektioner = [[Silisiumdioksid]] <br/> [[Germaniumdioksid]] <br/> [[Tindioksid]] <br/> [[blyoksid]] |
|||
| andrefunksj = [[Karbonmonoksid]] <br/> [[Karbonsuboksid]] <br/> [[Dikarbonmonoksid]] <br/> [[Karbontrioksid]] |
|||
| relfunksjon = |
|||
| andreforb = [[Karbonsyre]] <br/> [[Karbonylsulfid]] |
|||
}} |
|||
'''Karbondioksid''' er en [[kjemisk forbindelse]] av [[karbon]] og [[oksygen]] med [[kjemisk formel]] CO<sub>2</sub >, den er ikke-brennbart, [[Sur gass|sur]], fargeløs og luktfri [[gass]]. Den løser seg lett opp i [[vann]], hvor den også forekommer ofte, for eksempel i det som i dagligtale kalles kullsyre i leskedrikker, men som er en uriktig betegnelse. Med [[metalloksid]]er eller [[hydroksid]], kan karbondioksid danne to typer [[salt]]er, nemlig [[karbonat]]er og [[hydrogenkarbonat]]. |
|||
[[Fil:Carbon-dioxide-3D-vdW.svg|right|thumb|CO<sub>2</sub>-molekylet]] |
|||
[[Fil:CO2-Mauna-Loa.png|thumb|300px|'''Endringen av CO<sub>2</sub>-konsentrasjonen (i deler per million) fra 1958 til 2009.''' Man ser både en stigende trend og årlige svingninger. Trenden er menneskeskapt, og utgjør for tiden en økning på 2,0 [[parts per million|ppm]] per år. Svingningene skyldes at plantene forbruker mindre CO<sub>2</sub> om vinteren enn om sommeren.]] |
|||
[[Fil:CO2-417k.png|thumb|300px|'''Endringen av CO<sub>2</sub>-konsentrasjonen i luften gjennom de siste 417 000 år.''' Den røde delen av kurven viser økningen som har skjedd etter ca. 1800, og som for en stor del skyldes menneskeskapte utslipp pga. bruk av fossilt brensel.]] |
|||
[[Fil:CO2-src.png|thumb|300px|'''Årlige CO<sub>2</sub>-utslipp fra 1800 til 2006 etter opphav''' (svart: [[kull]], fiolett: [[olje]], gul: [[gass]], grå: resterende kilder, som f.eks. [[sement]]produksjon). Mengden er angitt i milliarder [[tonn]] karbon.]] |
|||
CO<sub>2</sub> er en viktig del av det globale [[karbonkretsløpet]], samt en naturlig del av [[luft]]en som en viktig [[Klimagass|drivhusgass]] i [[atmosfæren]]: Menneskelig aktivitet, spesielt forbrenning av [[Fossilt brensel|fossile]] [[energikilde]]r, har økt andelen [[parts per million]] (ppm) CO<sub>2</sub> i atmosfæren fra cirka 280 før [[Den industrielle revolusjon|starten av industrialiseringen]] til cirka 400 ppm i 2015. Denne tendensen er fortsatt stigende.<ref>Markus Reichstein: ''Universell und Überall. Der terrestrische Kohlenstoffkreislauf im Klimasystem''. In: Jochem Marotzke, Martin Stratmann (Hrsg.): ''Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft''. Beck, München 2015, ISBN 978-3-406-66968-2, S. 123-136, insb. S. 127.</ref> Denne økningen resulterer i en forsterkning av den naturlige [[drivhuseffekten]], som i sin tur er årsaken til dagens [[global oppvarming|globale oppvarming]].<ref>Jochem Marotzke: ''"Vorhersagen sind schwierig..." Möglichkeiten und Grenzen von Klimamodellen'', In: Ders., Martin Stratmann (Hrsg.): ''Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft''. Beck, München 2015, ISBN 978-3-406-66968-2, S. 9-22, hier S. 22.</ref> |
|||
'''Karbondioksid''' (foreldet og feilaktig også kalt ''kullsyre'') er i [[kjemi]]en en forbindelse hvor [[molekyl]]ene er satt sammen av ett [[Karbon (grunnstoff)|karbon]]- og to [[oksygen]]atomer med [[kjemisk formel|kjemiske formel]], '''CO<sub>2</sub>'''. Karbondioksid forekommer naturlig i [[atmosfæren]]. Noen målinger viser til at den kan ha utgjort 0,026 - 0,028 [[volumprosent]] av [[luft]]en de siste 10 000 år før [[den industrielle revolusjon]], men med store variasjoner tidligere i Jordens historie. Konsentrasjonen øker, og var i mars 2015 steget til 0,040 % (dvs. 401,5 [[ppm]]) i globalt [[gjennomsnitt]].<ref name="siste tall">[http://co2now.org CO2 Now]</ref><ref name="Carbon Trends">{{ cite web | url=http://www.esrl.noaa.gov/gmd/ccgg/trends/ | title=Trends in Carbon Dioxide | author=Tans, Pieter | publisher=[[National Oceanic and Atmospheric Administration|NOAA]]/[[Earth System Research Laboratory|ESRL]] | accessdate=2014-03-31}}</ref> |
|||
Ved forbrenning av stoffer som inneholder [[karbon]] med tilstrekkelig [[oksygen]] oppstår CO<sub>2</sub>. Gassen oppstår også i [[organisme]]r og levende vesener som et produkt av [[celleånding]]. [[Plante]]r, [[alger]]er og noen [[Blågrønnbakterier|bakterier]] og [[arkebakterier]] konverterer CO<sub>2</sub> etter [[karbon fiksering|fiksering]] i [[biomasse]]. Under [[fotosyntese]]n skapes [[glukose]] fra [[Uorganisk kjemi|uorganisk]] CO<sub>2</sub> og vann. |
|||
Ved [[atmosfæren]]s [[trykk]] kan karbondioksid kun eksistere i to [[Aggregattilstand|faser]]: gass (når temperaturen er over −78,5 °C) og fast stoff (kalt ''tørris''). Når fast karbondioksid oppvarmes, smelter det altså ikke, men går direkte over til gass, dvs. [[sublimasjon|sublimerer]]. |
|||
CO<sub>2</sub> kan være giftig, men konsentrasjonen i luften er langt fra nok til at det er skadelig. Den har et bred spektrum av teknisk anvendelser. I kjemiske industri brukes den for eksempel ved fremstilling av [[urea]]. I fast form som [[tørris]] er CO<sub>2</sub> mye brukt som [[kjølemiddel]], og som såkalt ''superkritisk karbondioksid'' blir brukt som [[Løsemiddel|løse-]] og [[Ekstrahering (kjemi)|ekstraheringsmiddel]]. |
|||
Lydfarten til CO2 er 267 meter pr. sekund. {{tr}} |
|||
== |
== Historie == |
||
[[File:Jan Baptist van Helmont.jpg|mini|left|[[Jan Baptist van Helmont]] kalte karbondioksid for ''Spiritus Sylvestre''.]] |
|||
{{Se også|Havforsuring}} |
|||
Når karbondioksid kommer i kontakt med [[vann]], dannes det [[karbonsyre]], også kjent som kullsyre, |
|||
CO<sub>2</sub> (g) + H<sub>2</sub>O ↔ H<sub>2</sub>CO<sub>3</sub> (aq) |
|||
Karbondioksid var en av de første gassene som fikk et navn. På 1600-tallet observerer den flamske kjemikeren [[Jan Johannes van Helmont]] at massen av [[trekull]] ble redusert under [[forbrenning]]en, ettersom massen av den gjenværende aske var mindre enn det kull som ble brukt. Hans tolkning var at resten av kullet hadde blitt omgjort til et usynlig stoff som han kalte gass eller ''Spiritus Sylvestre'' («Vild ånd»).<ref>William Emerson Brock, B. Kleidt, H. Voelker: ''Viewegs Geschichte der Chemie'', Springer-Verlag, ISBN 3-540-67033-5, S. 35.</ref> |
|||
[[Partialtrykket]] av CO<sub>2</sub>- avgjør om reaksjonen går i retning av karbonsyre eller i retning av fri CO<sub>2</sub>-gass. Denne likevekten er kjent fra mineralvann, øl og champagne, hvor naturlig eller tilført CO<sub>2</sub> danner karbonsyre med vannet i flasken. Når korken fjernes forsvinner overtrykket av CO<sub>2</sub> og karbonsyren går gradvis over til CO<sub>2</sub>. |
|||
Egenskapene til karbondioksid ble undersøkt mer grundig av den skotske legen [[Joseph Black]]. Han oppdaget i 1754 at når [[kalsium]] blandes i en løsning med syrer, frigjøres en gass som han kalte ''fixed air'' («fiksert/etablert luft»).<ref>William Emerson Brock, B. Kleidt, H. Voelker: ''Viewegs Geschichte der Chemie'', Springer-Verlag, ISBN 3-540-67033-5, S. 50.</ref> Han innså at denne gassen var tyngre enn luft og ikke opprettholder forbrenningprosesser. Ved injisering av denne gass i en oppløsning av [[kalsium]] så han at en [[fellingsreaksjon]] skjedde. Dette fenomen fikk ham til å forstå at karbondioksid oppstår i pusting hos pattedyr, og frembringes av mikrobiologisk [[fermentering]]. Hans arbeid viste at gasser kan være involvert i kjemiske reaksjoner, og bidro til at en vente seg bort fra teorien om [[flogiston]].<ref>William Emerson Brock, B. Kleidt, H. Voelker: ''Viewegs Geschichte der Chemie'', Springer-Verlag, ISBN 3-540-67033-5, S. 72.</ref> |
|||
Karbonsyre er en toprotisk [[syre]] med følgende to likevekter innstilt i vann:<br /> |
|||
H<sub>2</sub>CO<sub>3</sub> + H<sub>2</sub>O ↔ HCO<sub>3</sub><sup>-</sup> + H<sub>3</sub>O<sup>+</sup><br /> |
|||
HCO<sub>3</sub><sup>-</sup> + H<sub>2</sub>O ↔ CO<sub>3</sub><sup>2-</sup> + H<sub>3</sub>O<sup>+</sup> |
|||
[[Joseph Priestley]] lyktes i 1772 med den første produksjon av [[brus]] ved å tilføre [[svovelsyre]] i en kalkløsning, for deretter å oppløse den resulterende karbondioksid i en mugge med vann.<ref>J. Priestley, W. Hey: ''Observations on Different Kinds of Air. By Joseph Priestley, L L. D. F. R. S..'' In: ''Philosophical Transactions of the Royal Society of London.'' 62, 1772, S. 147–264, [[doi:10.1098/rstl.1772.0021]].</ref> I 1823 lyktes [[Humphry Davy]] og [[Michael Faraday]] med å gjøre karbondioksid om til en væske ved å øke trykket.<ref name="Davy">Humphry Davy: ''On the Applicatin of Liquids Formed by the Condensation of Gases as Mechanical Agents.'' In: ''Philosophical Transactions of the Royal Society of London'', 113 (1823): S. 199–205, [[doi:10.1098/rstl.1823.0020]].</ref> Den første beskrivelsen av fast karbondioksyd kommer fra Charles Thilorier, i 1834 trykksatt han en beholder med flytende karbondioksid. Da han åpnet beholderen fant han ut at en spontan fordampning finner sted, noe som fører til avkjøling slik at også en del faststoff av CO<sub>2</sub> ble dannet.<ref>Duane H. D. Roller, M. Thilorier: ''Thilorier and the First Solidification of a „Permanent“ Gas (1835).'' In: ''Isis.'' 43, 1952, S. 109, [[doi:10.1086/349402]].</ref> |
|||
== Biologisk betydning == |
|||
Karbondioksid inngår i de to mest grunnleggende [[kjemisk reaksjon|kjemiske reaksjonene]] i [[biologi]]en: |
|||
[[Fotosyntese]] og [[respirasjon]] (pusting). Menneskets pust består av rundt 4% CO<sub>2.</sub><ref>http://www.nhm.uio.no/geomus/leksi/c/CO2.htm</ref> |
|||
I fotosyntesen bruker [[plante]]ne [[solenergi]]en til å produsere [[druesukker]] og [[oksygen]] av karbondioksid og [[vann]]. |
|||
Respirasjon er den motsatte reaksjonen: |
|||
De fleste [[organisme]]r vinner [[energi]] ved å forbrenne druesukker med oksygen, og produserer karbondioksid og vann som «avfallsstoffer». |
|||
== Forekomst == |
|||
For å vise dette kan man blåse med et [[sugerør]] ned i en beholder med [[destillert vann]]. Måler man deretter [[pH-verdi]]en på vannet, vil denne verdien være lavere enn den var i utgangspunktet. Løsningen har altså blitt surere fordi det har blitt tilsatt CO<sub>2</sub>. |
|||
Karbondioksid er i [[Jordens atmosfære|atmosfæren]], i [[hydrosfære]]n, i [[litosfære]]n og [[biosfære]]n. Karbon utveksles mellom disse sfærene i stor grad i form av karbondioksid. I atmosfæren var det i 2015 rundt 830 [[Tonn|gigatonn]] (830 000 000 000 [[tonn]]) karbon i form av karbondioksid.<ref>Markus Reichstein: ''Universell und Überall. Der terrestrische Kohlenstoffkreislauf im Klimasystem''. In: Jochem Marotzke, Martin Stratmann (Hrsg.): ''Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft''. Beck, München 2015, ISBN 978-3-406-66968-2, S. 123-136, insb. S. 125.</ref> hydrosfæren inneholder cirka 38 000 gigatonn med karbon i form av fysisk oppløst karbondioksid, samt oppløst [[hydrogenkarbonat]]er og - [[karbonat]]er. Litosfæren omfatter den klart største andelen av kjemisk bundet karbondioksid. Karbonatbergarter som [[kalsitt]] og [[dolomitt]] inneholder cirka 60 millioner gigatonn karbon<ref>Martin Kappas: ''Klimatologie'', Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-1827-2, S. 159</ref> I tillegg til dette kommer innholdet av karbon i [[permafrost]]områder som [[tundra]]en i [[Arktis]] og [[Antarktis]] ved polområdene, [[boreal barskog]] eller fjellområder som lagrer store mengder karbon.<ref>Andrea Rehmsmeier: [http://www.deutschlandfunk.de/permafrost-auf-duennem-eis.740.de.html?dram:article_id=361564 ''Auf dünnem Eis''][[Deutschlandfunk]] – ''Wissenschaft im Brennpunkt'' vom 7. August 2016</ref><ref>[http://ipa.arcticportal.org/publications/ipa-country-reports ipa.arcticportal.org: ''International Permafrost Association''] (5. November 2016)</ref> |
|||
=== Forekomst i atmosfæren === |
|||
Det er karbondioksidnivået i luften i lungene som styrer pustingen. Hvis det er mer CO<sub>2</sub> i luften enn det normale, vil man puste raskere. Ved 2 % CO<sub>2</sub> i innåndingsluften blir åndedrettet 50 % raskere enn normalt. |
|||
[[Fil:Verlauf Kohlendioxidgehalt.png|mini|left|Utvikling av konsentrasjon av CO<sub>2</sub> i løpet av de siste 420 000 årene opptatt med direkte og indirekte målinger viser]] |
|||
[[Fil:Global carbon dioxide AIRS.jpg|mini|left|Global distribusjon av karbondioksid i troposfæren, registrert av ''Atmospheric Infrarød Sounder (AIRS)'' instrumentert av [[NASA]] i juli 2008.]] |
|||
{{Hoved|Liste over land etter karbondioksidutslipp}} |
|||
Karbondioksid blir tidvis omtalt som giftig.{{av hvem}} Sannsynligvis skyldes dette sammenblanding med [[karbonmonoksid]], som er meget giftig.{{tr}} |
|||
Karbondioksid er en [[sporgass]] i atmosfære. Konsentrasjonen i 2013 er lokalt overskred terskelen på 400 ppm ([[parts per million]], deler per million), som ble målt av [[National Oceanic and Atmospheric Administration]] (NOAA) i USA på [[Mauna Loa]], Hawaii.<ref>J. Ewald: ''Carbon Dioxide at NOAA’s Mauna Loa Observatory reaches new milestone: Tops 400 ppm''. In: ''NOAA Research'', 10. Mai 2013.</ref><ref>[https://www.youtube.com/watch?v=vA7tfz3k_9A Pumphandle 2012: Time history of atmospheric carbon dioxide], Video der Geschichte des atmosphärischen Kohlenstoffs in den letzten 800.000 Jahren, [http://carbontracker.noaa.gov/ carbontracker.noaa.gov]</ref><ref>{{kilde www |url=http://www.rp-online.de/wissen/klima/co2-dichte-in-atmosphaere-so-hoch-wie-nie-1.3389294 |forfatter= |tittel=400 Teile pro Million – CO<sub>2</sub>-Dichte in Atmosphäre so hoch wie nie |utgiver=[http://www.rp-online.de/ Rheinische Post] |arkivdato =2013-05-10 |besøksdato= 2013-12-23}}</ref> |
|||
Selv om karbondioksid ikke er giftig, vil et CO<sub>2</sub>-nivå på rundt 10% være dødelig etter kort tid. Hvis man er i et område hvor det lekker CO<sub>2</sub>, vil man omkomme av CO<sub>2</sub>-overskudd lenge før man dør av oksygenmangel. Årsaken ligger i at når man puster inn luft med et betydelig innhold av CO<sub>2</sub>, vil utskillingen av CO<sub>2</sub> fra lungene reduseres på grunn av at partialtrykksforskjellen mellom CO<sub>2</sub> i blodet og CO<sub>2</sub> i luften i lungealveolene bli mindre. Det blir da en opphopning av CO<sub>2</sub> i blodet. Blir denne opphopningen stor nok, vil man besvime og til slutt omkomme. |
|||
En studie publisert høsten 2016 i tidsskriftet [[Science]] kunne for første gang fremvise en lineær sammenheng mellom utslipp av CO<sub>2</sub> og smelting av sommerisen i Arktis: «Et tonn CO<sub>2</sub> = -3 km<sup>3</sup> sommeris».<ref>deutschlandfunk.de, ''Forschung aktuell'', 5. November 2016, Volker Mrasek: [http://www.deutschlandfunk.de/klimawandel-jeder-new-york-fluggast-laesst-drei.676.de.html?dram:article_id=370446 ''Jeder New-York-Fluggast lässt drei Quadratmeter Arktis-Meereis schmelzen''] (5. November 2016)</ref> |
|||
== Miljøtrussel == |
|||
Karbondioksid er en gass som dannes når man brenner [[fossilt brensel|fossile brensler]] slik som [[petroleum]], [[kull]], [[parafin]] og [[bensin]], eller et hvilket som helst organisk materiale. Karbondioksidets andel i atmosfæren har økt med om lag en tredjedel fra begynnelsen av den [[industrielle revolusjon]] til i dag, men har variert noe. Dette skyldes menneskelig aktivitet. Ser man på hele Jordens historie, er andelen av karbondioksid i atmosfæren i dag, med 400 ppmV ([[Parts per million|milliontedeler]] per volum), høyere enn noen gang de siste tre millioner år.<ref>{{kilde www|url=http://energiogklima.no/kommentar-analyse/400-ppm-milepael-til-besvaer/ |tittel=400 ppm: Milepæl til besvær |forfatter=[[Eystein Jansen]] |utgiver=Norsk klimastiftelse |besøksdato=31. mars 2014}}</ref> Det har vært høyere nivåer i tidligere tider, med ca. 2300 ppm for 159 millioner år siden og ca. 6600 ppm for 518 millioner år siden.{{tr}} |
|||
Den totale massen av karbondioksid i atmosfæren er cirka 3000 gigatonn eller cirka 800 gigatonn karbon (forholdet mellom [[molar masse]] av CO<sub>2</sub> til [[karbon|C]] er 44:12). Konsentrasjonen varierer både med årstidene og lokalt, spesielt på bakken. I urbane områder er konsentrasjonen generelt høyere i lukkede rom, der kan konsentrasjonen være opp til ti ganger høyere enn gjennomsnittet.<ref>{{kilde www |url=http://www.umwelt.niedersachsen.de/umweltbericht/schutzgueter/gesundheit_menschen/luft_und_klima/innenraumluftqualitaet/89268.html |forfatter= |tittel=Innenraumluftqualität: Kohlendioxid (CO<sub>2</sub>), Temperatur und Luftfeuchte in Schulklassenräumen |utgiver=[http://www.umwelt.niedersachsen.de/ Niedersächsisches Ministerium für Umwelt, Energie und Klimaschutz] |arkivdato=2013-09-25 |besøksdato=2013-05-19}}</ref> |
|||
Denne gassen bidrar til både økt næringsvekst og [[drivhuseffekt]]. Bidraget til [[sur nedbør]] er minimal. Drivhuseffekten per molekyl er langt mindre enn for mange andre gasser, men ettersom konsentrasjonen i atmosfæren er relativt høy og levetiden er lang, er den likevel en viktig [[klimagass]]. |
|||
Karbondioksid absorberer noe av varmestrålingen fra [[solen]] (den [[Infrarød stråling|infrarøde]]), mens den kortbølgede del av solstrålingen kan passere nesten uhindret. Et absorberende legeme avgir også varmestråling i henhold til sin temperatur. Disse funksjonene gjør karbondioksid til en såkalt [[klimagass]]. Etter [[vanndamp]] utgjør karbondioksid den andre store klimagassen i forhold til sin mengdeandel i atmosfæren, selv om den spesifikke virkningen av [[metan]] og [[ozon]] er høyere. Alle klimagasser sammen øker den gjennomsnittlige temperaturen på jordoverflaten på grunn av den naturlige [[drivhuseffekten]] fra cirka -18 °C til +15 °C. Karbondioksid har en relativt stor andel av den samlede effekten og dermed bidrar dermed til å gjøre klimaet vennlig for livet på jorden.<ref>Karsten Schwanke, Nadja Podbregar, Dieter Lohmann, Harald Frater: ''Naturkatastrophen. Wirbelstürme, Beben, Vulkanausbrüche – entfesselte Gewalten und ihre Folgen'', Springer Verlag, Berlin/Heidelberg 2009, ISBN 978-3-540-88684-6, S. 119.</ref> |
|||
==Kuldemedium== |
|||
Karbondioksid har fått fornyet anvendelse som kuldemedium de siste årene, spesielt innenfor [[komfortkjøling]] blant annet i biler. Fordelen med dette mediet er at det gir kompakte og energieffektive anlegg, mens utfordringen ligger i at anleggene må kjøres [[Transkritisk prosess|transkritisk]], noe som krever spesiell regulering. Ettersom karbondioksid ikke fremstilles spesielt for bruk som kuldemedium, regner en ikke tap av dette kuldemediet fra anlegg som et miljøproblem. |
|||
Atmosfærens innhold av karbondioksid har vært utsatt for store svingninger i løpet av historien, noe som har hatt ulike biologiske, kjemiske og fysiske årsaker. For 500 millioner år siden var karbondioksidkonsentrasjonen omtrent 20 ganger høyere enn dagens nivå.<ref>{{kilde www |url=http://earthguide.ucsd.edu/virtualmuseum/climatechange2/07_1.shtml |forfatter= |tittel=Carbon Dioxide through Geologic Time |utgiver=[http://www.earthguide.ucsd.edu/ Geoscience Research Division at Scripps Institution of Oceanography] |arkivdato= |besøksdato=2013-12-21}}</ref> Verdien sank jevnt og var i [[Jura (geologi)|jura]] omlag fire til fem ganger sin nåværende verdi. Siden da har verdien falt videre. I alle fall de siste 800 000 år har andelen alltid vært under 300 ppm.<ref name="DOI10.1038/nature06949">{{cite journal | author = Dieter Lüthi, Martine Le Floch, Bernhard Bereiter, Thomas Blunier, Jean-Marc Barnola, Urs Siegenthaler, Dominique Raynaud, Jean Jouzel, Hubertus Fischer, Kenji Kawamura, Thomas F. Stocker | authorlink = | year = 2008 | month = 5 | day = 15 | title = High-resolution carbon dioxide concentration record 650,000–800,000 years before present | journal = Nature | volume = 453 | issue = 7193 | pages = 379 | doi = 10.1038/nature06949 | pmid = }}</ref><ref name="DOI10.1126/science.1120130">{{cite journal | author = U. Siegenthaler | authorlink = | year = 2005 | month = 11 | day = 25 | title = stable Carbon Cycle-Climate Relationship During the Late Pleistocene | journal = Science | volume = 310 | issue = 5752 | pages = 1313 | doi = 10.1126/science.1120130 | pmid = }}</ref> Konsentrasjon av karbondioksid i den siste 10 000 år har holdt seg relativt stabilt på 300 ppm. Balansen i [[karbonkretsløpet]] har dermed vært i likevekt over dette tidsrommet. Fra begynnelsen av [[den industrielle revolusjon]] på 1800-tallet har karbondioksidinnholdet i atmosfæren økt. Den nåværende konsentrasjonen er trolig den høyeste på flere hundre tusen år.<ref name="Prentice et al. 2001">Iain Colin Prentice et al.: [http://www.grida.no/climate/ipcc_tar/wg1/096.htm ''The Carbon Cycle and Atmospheric Carbon Dioxide.''] In: ''IPCC Third Assessment Report.'' 2001, S. 185, abgerufen am 21. Dezember 2013.</ref><ref name="NASA-20151112-ab">{{cite web |last1=Buis |first1=Alan |last2=Ramsayer |first2=Kate |last3=Rasmussen |first3=Carol |title=A Breathing Planet, Off Balance |url=http://www.jpl.nasa.gov/news/news.php?feature=4769 |date=12 November 2015 |work=[[NASA]] |accessdate=13 November 2015 }}</ref><ref name="NASA-20151112b">{{cite web |author=Staff |title=Audio (66:01) - NASA News Conference - Carbon & Climate Telecon |url=http://www.ustream.tv/recorded/77531778 |date=12 November 2015 |work=[[NASA]] |accessdate=12 November 2015 }}</ref><ref name="NYT-20151110">{{cite news |last=St. Fleur |first=Nicholas |title=Atmospheric Greenhouse Gas Levels Hit Record, Report Says |url=http://www.nytimes.com/2015/11/11/science/atmospheric-greenhouse-gas-levels-hit-record-report-says.html |date=10 November 2015 |work=[[New York Times]] |accessdate=11 November 2015 }}</ref><ref name="AP-20151109">{{cite news |last=Ritter |first=Karl |title=UK: In 1st, global temps average could be 1 degree C higher |url=http://apnews.excite.com/article/20151109/climate_countdown-greenhouse_gases-d8a21f0397.html |date=9 November 2015 |agency=Associated Press |accessdate=11 November 2015 }}</ref> |
|||
I perioden 1960 til 2005 økte karbondioksidinnholdet med 1,4 ppm per år.<ref name="Canadell et al. 2007">J. G. Canadell, C. Le Quere, M. R. Raupach, C. B. Field, E. T. Buitenhuis, P. Ciais, T. J. Conway, N. P. Gillett, R. A. Houghton, G. Marland: ''Contributions to accelerating atmospheric CO<sub>2</sub> growth from economic activity, carbon intensity, and efficiency of natural sinks.'' In: ''Proceedings of the National Academy of Sciences.'' 104, 2007, S. 18866–18870, [[doi:10.1073/pnas.0702737104]].</ref> |
|||
[[Fil:Mauna Loa CO2 monthly mean concentration DE.svg|mini| [[Keeling-kurven]] viser økningen i atmosfærisk karbondioksid innhold siden 1958]] |
|||
De ''[[antropogen]]e'', altså menneskeskapte, utslipp av karbondioksid, er cirka 36,3 gigatonn per år.<ref name ="Canadell et al. 2007"/> Dette utgjør bare en liten andel av de fra naturlige kilder av karbondioksid som er på cirka 550 gigatonn per år.<ref name="IPCC 2001">{{kilde www |url=http://www.grida.no/publications/vg/climate/page/3066.aspx |forfatter= |tittel=GRID-Arendal: ''Vital Climate Graphics: The present carbon cycle'' |utgiver=[http://www.grida.no/ Grid Arendal] |arkivdato= |besøksdato=2013-12-21}}</ref> Men fordi det naturlige [[karbonsluk]]et opptar samme mengde CO<sub>2</sub> hold karbondioksidkonsentrasjonen seg relativt konstant før industrialiseringen. Den ekstra karbondioksiden er omtrent halvparten av [[biosfæren]]s og av verdenshavenes (som fører til [[Havforsuring|forsuring]]) opptak, slik at de nå absorberer mer karbondioksid enn de avgir.<ref>A. P. Ballantyne, C. B. Alden, J. B. Miller, P. P. Tans, J. W. C. White: ''Increase in observed net carbon dioxide uptake by land and oceans during the past 50 years.'' In: ''Nature.'' 488, 2012, S. 70–72, [[doi:10.1038/nature11299]].</ref> Den andre halvparten av karbondioksidutslippene forblir i atmosfæren, hvor det fører til målbar økning i konsentrasjonen. Denne kurven som viser økt karbondioksidkonsentrasjon er beskrevet av [[Charles David Keeling]], og den såkalte ''[[Keeling-kurve]]'' er oppkalt etter ham. Denne ble første gang vist i begynnelsen av 1960-årene. |
|||
Det er generelt akseptert at det er en statistisk signifikant menneskeskapt innflytelse på klimaet, som er delvis ansvarlig for den [[global oppvarming]]. Denne oppvarmingen har svært sannsynlig for en stor del sin årsak i økningen i drivhuseffekten på grunn av utslipp av klimagasser.<ref>S. A. Montzka, E. J. Dlugokencky, J. H. Butler: ''Non-CO2 greenhouse gases and climate change.'' In: ''Nature.'' 476, 2011, S. 43–50, [[doi:10.1038/nature10322]].</ref> Det karbondioksid som produseres i tillegg har en andel på cirka 60 % av drivhuseffekten.<ref name="Meehl et al. 2004">Gerald A. Meehl, Warren M. Washington, Caspar M. Ammann, Julie M. Arblaster, T. M. L. Wigley, Claudia Tebaldi: ''Combinations of Natural and Anthropogenic Forcings in Twentieth-Century Climate.'' In: ''Journal of Climate.'' 17, 2004, S. 3721–3727, {{DOI|10.1175/1520-0442(2004)017<3721:CONAAF>2.0.CO;2}}.</ref><ref name="Hansen et al. 2005">James E. Hansen, Makiko Sato, Reto Ruedy, Larissa Nazarenko, Andrew Lacis, Gavin A. Schmidt, Gary Russell et al.: ''Efficacy of climate forcings.'' In: ''Journal of Geophysical Research.'' Vol. 110, Issue D18, 27. September 2005, [[doi:10.1029/2005JD005776]].</ref> |
|||
I mars 2015 ble det i henhold til [[National Oceanic and Atmospheric Administration]] (NOAA) for første gang målt mer enn 400 ppm CO<sub>2</sub> i jordens atmosfære.<ref>{{Kilde www | forfatter= | url=http://www.stern.de/news/un-bericht--co2-konzentration-in-der-atmosphaere-hat-2015-rekordwert-erreicht-7116244.html | tittel=UN-Bericht: CO2-Konzentration in der Atmosphäre hat 2015 Rekordwert erreicht | besøksdato=22. januar 2017 | utgiver= Stern.de | arkiv_url= | arkivdato = 24. oktober 2016 }}</ref> |
|||
=== Forekomst i verdenshavene === |
|||
Vannet i havet inneholder karbondioksid i oppløst form, så vel som karbondioksid i likevekt med hydrogenkarbonater og karbonater. Den oppløste mengde varierer med årstidene, fordi den avhenger av temperaturen og saltinnholdet i vannet: Kaldt vann oppløser mer karbondioksyd enn varmt. Fordi kaldt vann har større tetthet, synker karbondioksidinnholdet i havene på dypere lag. Bare ved trykk over 300 bar og temperaturer over 120& nbsp;°C (393 K) er situasjonen anderledes, som i nærvær av dyp med geotermiske skorsteiner.<ref>Zhenhao Duan, Rui Sun: ''An improved model calculating CO<sub>2</sub> solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to 2000 bar.'' In: ''Chemical Geology.'' 193, 2003, S. 257–271, [[doi:10.1016/S0009-2541(02)00263-2]].</ref> |
|||
I havet er det omtrent 50 ganger mer karbon enn inneholdet i atmosfæren. Havet fungerer som en stort karbonsluk og absorberer cirka en tredjedel av den frigitte mengden karbondioksid fra menneskelig aktivitet.<ref>{{kilde www |url=http://www.whoi.edu/oceanus/viewArticle.do?id=17726 |tittel=How Long Can the Ocean Slow Global Warming? |forfatter=Naomi M. Levine, Scott C. Doney |utgiver=[http://www.whoi.edu/ Woods Hole Oceanographic Institution] |arkivdato=2006-11-29 |besøksdato=2013-12-21}}</ref> I de øvre lag av verdenshavene er karbondioksid delvis bundet av fotosyntesen. Med ved økende oppløsning av karbondioksid senkes [[alkalitet]]en til [[saltvann]], og det er fryktet at dette vil påvirke dannelsen av [[Konkylie|skjell]] hos organismer.<ref>Tom Garrison: ''Oceanography: an invitation to marine science'', 2005, Verlag Thomson Brooks/Cole, Belmont, CA, ISBN 0-534-40887-7, S. 505.</ref> På den annen side er det bevis for at økt karbondioksid konsentrasjon stimulerer noen arter til økt skjellproduksjon.<ref>J. B. Ries, A. L. Cohen, D. C. McCorkle: ''Marine calcifiers exhibit mixed responses to CO<sub>2</sub>-induced ocean acidification.'' In: ''Geology.'' 37, 2009, S. 1131–1134, [[doi:10.1130/G30210A.1]].</ref> |
|||
=== Forekomst i ferskvann === |
|||
Gjennom spesielle geologiske forhold kan ferskvann oppta betydelige mengder med karbondioksid, som vann fra mineralkilder eller i innsjøer i utdødde vulkaner, kalt ''[[Maar]]er''. I sjeldne tilfeller inntreffer naturkatastrofer på grunn karbondioksid. I 1986 inntraff en katastrofe på [[Lake Nyos]] i [[Kamerun]].<ref>{{kilde www |url=http://www.spiegel.de/wissenschaft/natur/0,1518,540201,00.html |forfatter= |title=Killer-Seen Lautloser Tod aus der Tiefe |utgiver=[http://www.spiegel.de/ Der Spiegel] |arkivdato=2008-03-07 |besøksdato=2012-12-21}}</ref> Innsjøen ligger i et gammelt vulkankrater i Oku-vulkansk område. Et magmakammer strømmet ut i innsjøen, og karbondioksid ble oppløst i vannet slik at det ble mettet. Sannsynligvis forårsaket et jordras at store mengder karbondioksid fra innsjøen ble sluppet ut, noe som drepte omkring 1700 innbyggere og 3500 dyr i omkringliggende landsbyer. I 1984 inntraff en liknende katastrofe ved Lake Monoun der vannet ble mettet med karbondioksid på grunn av en slik hendelse. Under denne spontane frigjøringen av karbondioksid omkom 37 mennesker. Dessuten har [[Kivusjøen]] i Sentral-Afrika høye konsentrasjoner av oppløste gasser på dypt vann. Det er anslått at rundt 250 km³ karbondioksid er oppløst i denne innsjøen.<ref>{{kilde www |url=http://www.eawag.ch/forschung/surf/gruppen/kivu/publications/Halbwachs_2002_Investigations_in_Lake_Kivu.pdf |forfatter=Michel Halbwachs, Klaus Tietze, Andreas Lorke, Clément Mudaheranwa |tittel=Investigations in Lake Kivu after the Nyiragongo Eruption of January 2002 |utgiver=Das Wasserforschungs-Institut des ETH-Bereichs |arkivdato=2002-03-09 |besøksdato=2012-12-21 |format=PDF; 2,5 MB}}</ref> |
|||
=== Forekomst utenom jorden=== |
|||
[[Fil:Ssc2004-08b.jpg|mini|Påvisning av karbondioksid (grønn) i protoplanetarisk skive {{byline|NASA}}]] |
|||
Atmosfæren på [[Venus]] består av cirka 96,5 % karbondioksid, og har en massen på cirka 90 ganger Jordens atmosfære, med et trykk på 90 [[bar]]. Det høye karbondioksidinnholdet er en årsak til den sterke drivhuseffekten på planeten. Videre i forhold til jorden har den gjennomsnittlig en 41 millioner kilometer kortere avstand fra solen, noe som resulterer i en overflatetemperatur på cirka 480 °C.<ref>{{kilde www |url=http://hyperphysics.phy-astr.gsu.edu/hbase/solar/venusenv.html |forfatter= |tittel=The Atmosphere of Venus |utgiver=[http://hyperphysics.phy-astr.gsu.edu/ Department of Physics and Astronomy Georgie State University] |arkivdato= |besøksdato=2010-03-22}}</ref> Karbondioksid er også den viktigste delen av atmosfære på [[Mars]], som utgjør rundt 95 % av innholdet.<ref>{{kilde www |url=http://www.scinexx.de/dossier-detail-41-13.html |forfatter= |tittel=Kohlendioxid (fast) pur … Atmosphäre und Klima des Roten Planeten |utgiver=[http://www.scinexx.de/ Scinexx, das Wissensmagazin] |arkivdato=2003-12-20 |besøksdato=2010-03-22}}</ref> På polene til Mars er den atmosfærisk delen av karbondioksid delvis bundet som tørris. Det atmosfæriske trykk er svært lavt, bare cirka syv millibar, noe som fører til at dens drivhuseffekten bare gir en økning av temperaturen på om lag 5 °C. Dette til tross for det høye karbondioksidinnhold. Atmosfærene til de ytre planetene i solsystemet, samt til deres satellitter, inneholder også karbondioksid. Opprinnelsen til denne er knyttet til konsekvensene av kometer som [[Shoemaker–Levy 9]] og kosmisk støv.<ref>E. Lellouch, B. Bezard, J.I. Moses, G.R. Davis, P. Drossart, H. Feuchtgruber, E.A. Bergin, R. Moreno, T. Encrenaz: ''The Origin of Water Vapor and Carbon Dioxide in Jupiter's Stratosphere.'' In: ''Icarus.'' 159, 2002, S. 112–131, [[doi:10.1006/icar.2002.6929]].</ref><ref>Dale P. Cruikshank, Allan W. Meyer, Robert H. Brown, Roger N. Clark, Ralf Jaumann, Katrin Stephan, Charles A. Hibbitts, Scott A. Sandford, Rachel M.E. Mastrapa, Gianrico Filacchione, Cristina M. Dalle Ore, Philip D. Nicholson, Bonnie J. Buratti, Thomas B. McCord, Robert M. Nelson, J. Brad Dalton, Kevin H. Baines, Dennis L. Matson: ''Carbon dioxide on the satellites of Saturn: Results from the Cassini VIMS investigation and revisions to the VIMS wavelength scale.'' In: ''Icarus.'' 206, 2010, S. 561–572, [[doi:10.1016/j.icarus.2009.07.012]].</ref> Med instrumenter som [[Hubble-teleskopet]] har NASA funet [[eksoplanet]]er som [[HD 189733 b]] med karbondioksid.<ref>{{kilde www |url=http://www.innovations-report.de/html/berichte/physik_astronomie/hubble_finds_carbon_dioxide_extrasolar_planet_124057.html |forfatter= |tittel=Hubble finds carbon dioxide on an extrasolar planet |utgiver=[http://www.innovations-report.de/ Inoovations-Report, Forum für Wissenschaft, Industrie und Wirtschaft] |arkivdato=2008-12-10 |besøksdato=2010-03-22}}</ref> |
|||
Karbondioksid er funnet både i det interstellare rom, i den [[protoplanetarisk skive]] og rundt unge stjerner.<ref>L.B. d'Hendecourt, M. Jourdain de Muizon: ''The discovery of interstellar carbon dioxide.'' In: ''Astronomy and Astrophysics'', 223 (1989), S. L5–L8 ([http://adsabs.harvard.edu/full/1989A%26A...223L...5D Volltext]).</ref> Dannelsen skjer ved overflatereaksjoner med [[karbonmonoksid]] og oksygen til vann- og ispartikler ved temperaturer rundt -123 °C (150 K). Ved fordampning av isen frigjøres karbondioksid.<ref>{{kilde bok |forfatter=Rebecca L. Rawls |tittel=Interstellar Chemistry |Sammelwerk=[[Chemical & Engineering News]] |Band=80 |Nummer=28 |arkivdato=2002 |Seiten=31–37 |Online=http://pubs.acs.org/isubscribe/journals/cen/80/i28/html/8028sci1.html |besøksdato=2017-01-09}}</ref> I det frie rommet mellom, er konsentrasjonen forholdsvis lav, ettersom vann og karbonmonoksid er dannet ved reaksjoner med atomært og molekylært hydrogen.<ref>D. Talbi, E. Herbst: ''The gas-phase destruction of interstellar carbon dioxide: Calculations on the reactions between CO<sub>2</sub> and H<sub>2</sub> and between CO<sub>2</sub> and H.'' In: ''Astronomy and Astrophysics.'' 386, 2002, S. 1139–1142, [[doi:10.1051/0004-6361:20020312]].</ref> |
|||
== Utvinning og produksjon == |
|||
Karbondioksid som produseres ved forbrenning av karbonholdige brennstoffer, spesielt [[Fossilt brensel|fossile]] [[energikilde]]r. Totalt blir omtrent 36 milliarder tonn karbondioksid per år frigjort i verden, og dette blir sluppet ut i atmosfæren. Prosesser for [[karbonfangst og -lagring]] er for tiden (2016) i begynnelsen av sin utvikling, og er ennå ikke klar for serieproduksjon. Metodenes effektivitet og lønnsomhet, spesielt i sammenheng med bærekraftige energisystemer, blir vurdert kritisk.<ref>Henrik Lund, Brian Vad Mathiesen, ''The role of Carbon Capture and Storage in a future sustainable energy system''. In: ''Energy'' 44, (2012), 469-476, [[doi:10.1016/j.energy.2012.06.002]].</ref> |
|||
Karbondioksid dannes ved reaksjon mellom [[karbon]] og [[oksygen]]: |
|||
:<math>\mathrm{C\ +\ O_2 \longrightarrow \ CO_2 \ ; \quad \Delta} H = -394 \; \mathrm{kJ/mol}</math><ref>o.A.: ''Schülerduden Chemie'', Bibliografisches Institut & F.A. Brockhaus AG, Mannheim 2007, ISBN 978-3-411-05386-5, S. 195.</ref> |
|||
Teknisk sett er karbondioksid generert når en brenner [[koks]] med luftoverskudd. Ved [[Gassverk|kullforgassing]] og [[dampreforming]] av naturgass, er karbondioksid et produkt av vann-gass-skiftreaksjonen i syntesegassproduksjon: |
|||
:<math>\mathrm{ CO + H_2O \;\overrightarrow{\leftarrow}\; CO_2 + H_2} \qquad \Delta H_{R\ 298}^0 = -41{,}2\ \mathrm{kJ/mol} </math> |
|||
For anvendelse i [[Haber–Bosch-prosessen]] og metanolproduksjon blir syntesegassen vasket, for eksempel ved rectisolmetoden, slik at karbondioksid blir produsert i store mengder i meget ren form.<ref>G. Hochgesand: ''Anwendung von Absorptionsverfahren für die CO<sub>2</sub>-Entfernung aus Natur- und Synthesegasen.'' In: ''Chemie Ingenieur Technik – CIT.'' 40, 1968, S. 432–440, [[doi:10.1002/cite.330400904]].</ref><ref>Birgit Kessler, Jörg Von Eysmondt, Heinrich Merten: ''Nutzung von CO<sub>2</sub> aus Rauchgasen für chemische Synthesen.'' In: ''Chemie Ingenieur Technik.'' 64, 1992, S. 1075–1083, [[doi:10.1002/cite.330641207]].</ref> Karbondioksid oppstår som et biprodukt ved [[kalkovn|kalkbrenning]]. Ved påfølgende rensing ved dannelsen av kaliumkarbonat til bikarbonat og påfølgende utslipp ved oppvarming, blir om lag 530 millioner tonn gjenvunnet hvert år. |
|||
For anvendelse i et laboratorium kan karbondioksid frigjøres fra [[kalsium]] og [[saltsyre]], for eksempel i et [[Kipp's apparat]]. Enheten var tidligere i mye brukt i laboratorier, men metoden blir nå sjelden brukt, siden karbondioksid er tilgjengelig i gassflasker eller som [[tørris]].<ref>H. Kolbe: ''Antiseptische Eigenschaften der Kohlensäure.'' In: ''Journal für Praktische Chemie.'' 26, 1882, S. 249–255, [[doi:10.1002/prac.18820260116]].</ref> |
|||
== Egenskaper == |
|||
[[Fil:Colored phase diagram of carbon dioxide (multi language).svg| |
|||
|mini|mini|[[Fasediagram]] for karbondioksid (ikke i målestokk)]] |
|||
[[Fil:Kristallstruktur-Kohlenstoffdioxid.png|mini|[[Krystallstruktur]] i [[tørris]].]] |
|||
=== Fysiske egenskaper === |
|||
Karbondioksid opptrer ved [[Standard trykk og temperatur|normalt trykk]] som et fast stoff ved temperaturer under -78,5 °C. Dette stoffet kalles [[tørris]]. Hvis dette blir oppvarmet vil det ikke smelte, men blir [[Sublimasjon|sublimert]] direkte til [[gass]]form. |
|||
[[Trippelpunkt]] der de tre fasene av faststoff, væske og gass finnes ved [[termodynamisk likevekt]], er ved en temperatur på -56,6 °C og et trykk på 5,19 [[Bar (enhet)|bar]].<ref name="GESTIS">{{kilde www|tittel=Carbon dioxide | utgiver=dguv.de | |
|||
|url=http://gestis-en.itrust.de/nxt/gateway.dll/gestis_en/001120.xml?f=templates$fn=default-doc.htm$3.0|arkivdato= | besøksdato=22. januar 2017}}.</ref> |
|||
Den [[Kritisk punkt|kritiske temperaturen]] er 31,0 °C, det kritiske trykket 73,8 bar og den kritiske tettheten 0,468 g/cm³.<ref name="GESTIS" /> Under den kritiske temperaturen kan karbondioksid komprimeres ved trykkøkning til en fargeløs væske.<ref name="HoWi" /> Ved romtemperatur kreves et trykk på cirka 60 bar for at CO<sub>2</sub> skal være i væskeform. |
|||
Fast karbondioksid krystalliserer i [[kubisk]] [[krystallstruktur]] i [[romgruppe]] Pa-3 (romgruppe nummer 205) med gitterparameteren ''a'' = 562,4 [[Picometer|pm]].<ref>A. Simon und K. Peters: ''Single-crystal refinement of the structure of carbon dioxide.'' In: ''Acta Crystallographica Section B.'' 1980, B36, S. 2750–2751, [[doi:10.1107/S0567740880009879]].</ref> |
|||
Karbondioksid absorberer [[elektromagnetisk stråling]] hovedsakelig i regionen av spektret av [[infrarød]], noe som gir [[molekylær vibrasjon]]er. Dette er selve årsaken til stoffets egenskap som [[klimagass]]. |
|||
Dens [[løselighet]] i vann er forholdsvis høy. Ved 20 °C under [[Standard trykk og temperatur|normalt trykk]] er metning i likevekt med ren karbondioksid ved 1688 mg/l. For sammenligning er løseligheten av oksygen eller nitrogen som følger: I rent oksygen er metningen allerede nådd ved 44 mg/l og ved ren nitrogen ved 19mg/l.<ref>Frank Wisotzky:''Angewandte Grundwasserchemie, Hydrogeologie und hydrogeochemische Modellierung: Grundlagen, Anwendungen und Problemlösungen'', 2011, Springer Verlag, ISBN 978-3-642-17812-2, S. 65.</ref> I standard tilstand er [[tetthet]] av karbondioksid 1,98 kg/m³.<ref name="Bau">Roland Benedix: ''Bauchemie''. Vieweg+Teubner Verlag, ISBN 978-3-8348-0584-3, S. 113.</ref> |
|||
=== Molekylære egenskaper === |
|||
Karbondioksidmolekylet er lineært, det vil si at alle tre atomer ligge på en rett linje. Karbonet er bundet til to oksygenatomer med [[dobbeltbinding]]er, begge oksygenatomene har to frie elektronpar. Karbon-oksygen avstanden er 116,32 pm<ref name="HoWi">{{Kilde bok | forfatter=A. F. Holleman, E. Wiberg, N. Wiberg: | tittel=Lehrbuch der Anorganischen Chemie | artikkel= | utgivelsesår=1995 | forlag= de Gruyter | isbn=3-11-012641-9 | url= | side=860 }}</ref> Karbon-oksygenbindinger er polarisert på grunn av de forskjellige elektronegativitetene til karbon og oksygen. Imidlertid vil de elektriske dipolmomenter oppheve hverandre utover på grunn av symmetri, slik at molekylet ikke har noe elektrisk dipolmoment. |
|||
=== Kjemiske egenskaper === |
|||
[[Fil:Drinking glass 00118.gif|mini|Boblende karbondioksid]] |
|||
Oppløst i vann danner karbondioksid [[karbonsyre]] (H<sub>2</sub>CO<sub>3</sub>), hvor mer enn 99 % av karbondioksidet bare er fysisk oppløst. Derfor er den vandige løsningen svakt sur. Karbonsyre som sådan, og den oppløste karbondioksid, er i en [[Kjemisk likevekt|likevekt]] med deres [[Dissosiasjon (kjemi)|dissosiative stoffer]] [[hydrogenkarbonat]] (''bikarbonat'', HCO<sub>3</sub><sup>-</sup>) og [[karbonat]] (CO<sub>3</sub><sup>2-</sup>), som er i et [[pH]]-verdi avhengig forhold til hverandre. I vann ligger denne likevekten hovedsakelig mot siden av karbondioksid og bare i liten grad dannes det hydrogenkarbonationer. |
|||
Dersom oksoniumioner (H3O<sub>3</sub>) som er dannet i løpet av dissosiasjon blir oppfanget ved tilsetning av en alkalisk oppløsning med hydroksidioner (OH<sup>-</sup>), idet mengdeforholdet skifter i favør av karbonater. |
|||
:<math>\rm CO_2 + 2\ H_2O \rightleftarrows HCO_3^- + H_3O^+</math> |
|||
:<math>\rm HCO_3^- + H_2O \rightleftarrows CO_3^{2-} + H_3O^+</math> |
|||
Karbondioksid er en meget svak [[oksidasjonsmiddel]]. Uedle metaller som for eksempel [[magnesium]] fungerer som et sterk [[reduksjonsmiddel]], reagere i med karbondioksid til å danne karbon og metalloksider:<ref>Hans-Dieter Barke: ''Chemiedidaktik heute''. Springer-Verlag, Berlin 2001, ISBN 3-540-41725-7, S. 30.</ref> |
|||
:<math>\mathrm{CO_2 + 2\ Mg \longrightarrow \ C + 2\ MgO}</math> |
|||
På grunn av den positive partialladningen til karbon reagerer karbondioksid som [[elektrofil]] i [[karboksylering]] av ''karbon nukleofiler'' slik som ''metall-alkylider'' eller ''alkylmagnesium'' for å danne en karbon-karbon-binding. Med karbondioksid reagerer med fenolsyre med reaksjonsstoffet [[fenolkarboksylsyrer]]. |
|||
== Anvendelse == |
|||
Karbondioksid brukes i industrien til mange forskjellige formål. Det er billig, ikke-brennbart og anvendes som komprimert gass, i flytende form, som tørris eller i superkritisk fase. Den kjemiske industrien anvender karbondioksid som et råmateriale for kjemiske synteser. |
|||
=== Bruk i næringsmiddelteknologi === |
|||
[[Fil:Sodastream-offen.jpg|mini|oppreist|150px|En beholder for tilsetting av karbondioksid i drikkevann.]] |
|||
I drikker som inneholdt karbondioksid stimuleres [[Smak|reseptorceller]] i munnen, noe som har en forfriskende effekt. For drikker som [[øl]] eller [[champagne]] kommer karbondioksid fra gjæringsprosessen. I andre drikker som [[limonade]] eller sodavann blir CO<sub>2</sub> kunstig tilsatt, eller det benyttes [[naturlig mineralvann]] som inneholder CO<sub>2</sub>. Ved produksjon av slike varer blir karbondioksid pumpet inn i drikken under høyt trykk. Der cirka 0,2% av vannet reagerer med karbondioksid og danner karbonsyre, mens den største del går i oppløsning som en gass i vannet. Som [[Tilsetningsstoff (næringsmidler)|tilsetningsstoff]] kalles karbondioksid for E 290.<ref>{{Kilde www | forfatter= | url= http://www.matvareguiden.no/naeringsstoff105.asp | tittel=Informasjon om Karbondioksid |
|||
| besøksdato=19. januar 2017 | utgiver=matvareguiden.no | arkiv_url= |arkivdato= }}</ref> |
|||
[[Gjær]] utvikler ved gjæring av [[sukker]] karbondioksid som benyttes som hevemiddel ved fremstilling av [[Gjærdeig|deig]]. [[Bakepulver]] er en blanding av natriumbikarbonat og et surt [[salt]] er også brukt som et hevemiddel, men gir ikke karbondioksid.<ref>{{kilde www |url=http://www.adler-muehle.de/info/Hefe.html |forfatter= |tittel=Info-Broschüre – Backen mit Hefe |werk=[http://www.adler-muehle.de/ Adler-Mühle] |arkivdato= |besøksdato=2010-03-22}}</ref> |
|||
Ved produksjon av vin brukes tørris som kjølemiddel for å avkjøle nylig plukket druer uten fortynning med vann, noe som vil kunne skape spontan gjæring. Vindyrkerne i [[Beaujolais]] i Frankrike bruker [[kullsyregjæring]] for å produsere "Beaujolais Primeur ''.<ref>Hugh Johnson, Steven Brook: ''Der große Johnson. Die Enzyklopädie der Weine, Weinbaugebiete und Weinerzeuger der Welt'', Verlag Gräfe und Unzer GmbH, 2009, ISBN 3-8338-1621-X, S. 135.</ref> |
|||
Ved lagring av frukt og grønnsaker spiller temperaturen en viktig rolle, men det samme gjør også sammensetningen av atmosfæren der disse produktene oppbevares. Hos fruktprodusenter og butikker kan epler som lagres i kontrollerte omgivelser være holdbare i flere tiår. Kunnskapen om at moden frukt forbruker oksygen og avgir karbondioksid, og at en atmosfære uten oksygen vil føre til at modningen stopper, går tilbake til begynnelsen av 1800-tallet. På 1930-tallet ble det for første gang konstruert et lager der innholdet av oksygen og karbondioksid i luften kontrolleres, dette ble utprøvd i Storbritannia.<ref name="Thompson">A. Keith Thompson: ''Fruit and Vegetables Harvesting, Handling and Storage,'' Blackwell Publishing, Oxford 2003, ISBN 1-4051-0619-0, S. 61–70.</ref> Den økonomiske betydningen av nøyaktig kontrollerte atmosfærer for fruktlagring er stor. Med tilsetning av karbondioksid til atmosfæren kan holdbarheten forlenges med flere måneder, dermed blir en mindre avhengigheten av import fra varmere strøk om vinteren og våren. På den annen side kan uriktig tilsetning av karbondioksid føre til feil i fruktkjøttet, dermed kan et helt lager eller en containertransport bli verdiløs.<ref>Hannah James und Jenny Jobling: ''The Flesh Browning Disorder of ‘Pink Lady’™ Apples.'' In: ''New York Fruit Quarterly,'' Band 16, Nr. 2, 2008, S. 23–28 [http://www.nyshs.org/pdf/fq/2008-Volume-16/Vol-16-No-2/The-Flesh-Browning-Disorder-of-Pink-Lady-Apples.pdf Online PDF], 594 kB. Abgerufen am 22. Dezember 2013.</ref> De biokjemiske prosessene som fører til den forsinkede modning av frukt er ennå ikke forstått. For tiden er det antatt at både bremsing av modningsprosessen og dannelsen av forskjellige feil forårsaket av stressresponser blir styrt på cellenivå.<Ref name="Thompson" /> |
|||
Frukt, grønnsaker og sopper som i [[detaljhandel]] blir pakket i folie,<ref>Irene Palacios et al.: ''Use of Modified Atmosphere Packaging to Preserve Mushroom Quality during Storage.'' In: ''Recent Patents on Food, Nutrition & Agriculture'', Band 3, Heft 3, 2012, S. 196–203, [[doi:10.2174/2212798411103030196]]</ref> blir gjerne utstyrt med en beskyttende atmosfære, dette for å forlenge holdbarheten. Dette gir også en beskyttelse av friskheten på vei til forbrukeren. I dag blir også kjøtt, fisk og sjømat, pasta, bakervarer og meieriprodukter solgt i slik forpakning. Typiske nivåer er 20 % karbondioksid for storfekjøtt, 50 % for storfekjøtt, svinekjøtt og pasta, 60 % for bakervarer og hele 80 % for fisk. En emballasje med bare karbondioksid unngås. Dette fordi det ville kunne føre til utviklingen av sykdomsfremkallende anaerobe bakterier, og i mange tilfeller påvirke farge og smak på produktene. Bestemmelse av optimal beskyttende atmosfære for et produkt er gjenstand for intens forskning i matindustrien.<ref>Anne Emblem: ''Predicting packaging characteristics to improve shelf-life.'' In: David Kilcast und Persis Subramaniam (Hrsg.): ''The stability and shelf-life of food,'' 2000, Woodhead Publishing, Cambridge (UK), ISBN 1-85573-500-8, S. 145–169.</ref><ref>Joseph P. Kerry (Hrsg.): ''Advances in meat, poultry and seafood packaging,'' 2012, Woodhead Publishing, Cambridge (UK), ISBN 978-1-84569-751-8.</ref> |
|||
[[Superkritisk karbondioksid]] har høy løselighet for [[Polaritet (kjemi)|upolare]] stoffer og kan erstatte giftige organiske [[løsemiddel|Løsemidler]]. Det brukes som [[ekstraksjonsmiddel]], for eksempel for utvinning av ''naturstoffer'' som [[koffein]] ved fremstilling av koffeinfri kaffe.<ref>{{kilde www |url=http://www.patent-de.com/19940224/DE3882965T2.html |forfatter=Saul Norman Katz |tittel=Verfahren zum Entkoffeinieren von Kaffee mit einer superkritischen Flüssigkeit |utgiver=|arkivdato=1988-12-22 |besøksdato=2013-12-21}}</ref> |
|||
=== Teknisk anvendelse === |
|||
Karbondioksid anvendes ved [[Brannvern|brannslokking]] på grunn av sin egenskap til å fortrenge oksygen, spesielt i [[brannslokningsapparat]]er og automatiske slukkeanlegg. CO<sub>2</sub>-brannslukningssystemer anvendes for å beskytte siloer eller lagerrom for brannfarlige væsker ved å fylle hele rommet med karbondioksid. Dette har imidlertid ført til gjentatte ulykker, med kvelning til følge.<ref>{{kilde www |url=http://www.rp-online.de/nrw/staedte/moenchengladbach/feuerwehr-zu-gasunfall-keine-einsatz-fehler-aid-1.674770 |forfatter= |tittel=Feuerwehr zu Gasunfall: "Keine Einsatz-Fehler" |utgiver=[http://www.rp-online.de/ Rheinische Post] |arkivdato=2008-08-20 |besøksdato=2013-12-21}}</ref> En studie av US Environmental Protection Agency ([[Environmental Protection Agency (USA)|EPA]]) raporterte om 51 ulykker i tidsrommet 1975-1997 med 72 dødsfall og 145 skadete på grunn av slike anlegg.<ref>{{kilde www |url=http://www.epa.gov/Ozone/snap/fire/co2/co2report.html |forfatter= |tittel=Carbon Dioxide as a Fire Suppressant: Examining the Risks |utgiver=[http://www.epa.gov/ U.S. Environmental Protection Agency] |arkivdato=2010-08-19 |besøksdato=2010-03-22}}</ref> |
|||
Karbondioksid brukes som [[kuldemedium]] i bilbransjen og stasjonære [[klimaanlegg]], som industriell kjøling, supermarkeder og transportkjøling og drikkemaskiner.<ref>{{kilde www |url=http://www.dkv.org/index.php?id=9&no_cache=1&tx_fsdatasets_pi1'page'=all&tx_fsdatasets_pi1'item'=102 |forfatter= |tittel=Kohlendioxid – Besonderheiten und Einsatzchancen als Kältemittel |utgiver=[http://www.dkv.org/ Deutscher Klima- und Kältetechnischer Verein] |arkivdato= |besøksdato=2010-03-22}}</ref> Den har en stor volummessig kjølekapasitet og dermed en høy effektivitet for et gitt volum. Karbondioksid har en lav miljøbelastning, ettersom det [[GWP-verdi|globale oppvarmingspotensialet]] bare er en brøkdel av de vanlige kjølemedier som brukes i dag. Det har heler ingen ozonnedbrytende potensiale. Karbondioksid blir anvendt i sentralvarmesystemer og oppvarming i kjøretøyer.<ref>{{kilde www |url=http://www.umweltbundesamt.de/uba-info-presse/2008/pd08-043.htm |forfatter= |tittel=Natürliches Kältemittel für Pkw-Klimaanlagen |utgiver=[http://www.umweltbundesamt.de/ Umweltbundesamt] |arkivdato=2008-06-09 |besøksdato=2010-03-22}}</ref> I gasskjølte [[atomreaktor]]er av type som ''Advanced Gas-cooled Reactor'' blir karbondioksid brukt som kjølemiddel. |
|||
Karbondioksid blir anvendt som en [[inertgass]] innenfor sveiseteknologi, enten i ren form eller som et tilsetningsstoff sammen med [[argon]] eller [[helium]]. Ved høye temperaturer er CO<sub>2</sub> termodynamisk ustabil derfor er det ikke er referert til som lite reaksjonsvillig, i stedet blir det da omtalt som en aktiv gass.<ref>{{kilde www |url=http://www.dvs-ev-bvschwaben.de/files/presse/Metall-Aktivgasschweiessn-JugendSchweisst.pdf |forfatter= |tittel=Metall-Aktivgasschweißen (MAG/135) |utgiver=[http://www.dvs-ev-bvschwaben.de/ Deutscher Verband für Schweißen und verwandte Verfahren] |arkivdato= |besøksdato=2010-03-22 |format=PDF; 42 kB}}</ref> |
|||
[[Fil:Carbon Dioxide Laser At The Laser Effects Test Facility.jpg|mini|En kontinuerlig bølge karbondioksidlaser for koaksial elektrisk utladning med ytelse 50 000 watt.]] |
|||
I en såkalt ''karbondioksidlaser'' strømmer kontinuerlig en ''lasergass'' gjennom utladningsrøret, denne består av en blanding av [[nitrogen]], [[helium]] og karbondioksid. I tillegg til den vanlige faste laseren, er det en av de mest bruket industrielt gasslasere med ytelse mellom 10 [[Watt|W]] og 20 kW. Virkningsgraden er omtrent 10 til 20 %.<ref>Douglas A. Skoog, James J. Leary, S. Hoffstetter-Kuhn: ''Instrumentelle Analytik: Grundlagen – Geräte – Anwendungen''. Springer-Verlag, ISBN 3-540-60450-2, S. 285.</ref> |
|||
I flytende form omsettes karbondioksid i [[gassflaske]]r. Det finnes to typer: flasker med stigerør for uttak av flytende karbondioksid og flaske uten stigerør for uttak av karbondioksid i gassform.<ref>{{kilde www |url=http://www.klein-schankanlagen.de/downloads/ASI_6_80.pdf |forfatter= |tittel=Druckgase zur Versorgung von Getränkeschankanlagen |utgiver=[http://www.portal.bgn.de/ Berufsgenossenschaft Nahrungsmittel und Gastgewerbe] |arkivdato=2012-02-01 |besøksdato=2010-03-22 |format=PDF }}</ref> Begge må være i vertikal posisjon ved transport. Flasken uten stigerør anvendes med trykkreduksjonsventil, mens den med stigerør hovedsakelig drives uten. Så lenge det fremdeles er flytende karbondioksid i trykkflasken, er det indre [[trykk]]et bare avhengig av temperaturen. En måling av fyllingsnivået er derfor bare mulig via veiing for begge flasketypene. Kapasiteten for uttak av gass er begrenset av hvor mye varme som kan absorberes fra omgivelsene, den flytende karbondioksiden må nemlig fordampe i flasken for å gjenoppbygge det trykk som tilsvarer gjeldende temperatur. |
|||
[[Sublimasjon]] av [[tørris]] frembringer en hvit tåke fra den kalde karbondioksid-luftblanding, samt kondensasjon av luftfuktigheten i omgivelsene. Dette gir visuelle effekter som blir brukt i teater og konserter. I dag er det vanlig med tåkekjøling som tilleggsutstyr for [[røykmaskin]]er, som drives med flytende karbondioksid.<ref>{{kilde www |url=http://www.powtech.de/Filestore.aspx/i4.6.pdf?fair=powtech&type=file&key=e0612d20-6413-4f77-9cfd-bc4b226096d0&language=de&filegroup=&filetype=file&indexfile=true |tittel=Merkblatt – Verwendung von Nebelgeräten |besøksdato=2010-03-22 |format=PDF}}</ref> |
|||
I økende grad blir karbondioksid anvendt i forbindelse med automatiserte prosesser for [[sandblåsing]] der overflater med spesielt høy renhet etterstrebes. Med sin kombinasjon av mekaniske, termiske og kjemiske egenskaper, kan «karbondioksid-snø», for eksempel oppløse og fjerne forskjellige typer av overflateurenheter uten gjenværende rester. <ref>Mark Krieg: ''Trockeneisstrahlen – mit Schnee oder mit Pellets?'' In: ''JOT Journal für Oberflächentechnik'', 45.6 (2005): S. 50–55.</ref> |
|||
Superkritisk karbondioksid er et løsemiddel som brukes til rengjøring og avfetting, for eksempel [[wafer]]e i halvlederindustrien og tekstiler i [[renseri]]er.<ref>N. Dahmen, P. Griesheimer, A. Hebach: ''Reinigung und Oberflächenbehandlung mit komprimiertem Kohlendioxid.'' In: Galvanotechnik, 98 (2007) S. 1111–1120.</ref> Karbondioksid i denne tilstanden benyttes også som et reaksjonsmedium for produksjon av [[finkjemikalier]]. Disse brukes for eksempel til fremstilling av smakstilsetninger, fordi isolerte [[enzym]]er ofte forblir aktive og ingen rester av oppløsningsmidler forblir i produktene, i motsetning til organiske oppløsningsmidler. |
|||
I tertiære oljeutvinning blir superkritisk karbondioksid brukt til fylling av oljereservoar for å rense oljen fra større dyp til overflaten.<ref>F. M. Orr, J. J. Taber: ''Use of Carbon Dioxide in Enhanced Oil Recovery.'' In: ''Science.'' 224, 1984, S. 563–569, [[doi:10.1126/science.224.4649.563]].</ref> |
|||
=== Bruk som kjemisk råstoff === |
|||
I den kjemiske industri er karbondioksid brukt ved omsetning av [[ammoniakk]], spesielt ved fremstilling av [[urea]]. I det første trinnet reagerer ammoniakk og karbondioksid til [[ammoniumkarbonat]], som i det andre trinn reagerer videre under dannelse av urea og vann:<ref name="Behr">{{kilde www |url=http://www.aktuelle-wochenschau.de/2008/woche20/woche20.html |forfatter=Arno Behr |tittel=Katalytische Kohlendioxid-Chemie |utgiver=[http://www.aktuelle-wochenschau.de/ Aktuelle Wochenschau der GDCh] |arkivdato= |besøksdato=2013-12-21}}</ref> |
|||
:<math>\mathrm{2 \ NH_3 + CO_2 \longrightarrow \lbrack H_2N{-}CO{-}O \rbrack NH_4}</math> |
|||
:<math>\mathrm{\lbrack H_2N{-}CO{-}O \rbrack NH_4 \longrightarrow H_2N{-}CO{-}NH_2 + H_2O}</math> |
|||
Ved reduksjon med hydrogen blir [[formamide]] dannet. Vider vil reaksjon med aminer, så som [[Dimetylamin]] blir [[dimetylformamid]] dannet.<ref>A. Behr, P. Ebbinghaus, F. Naendrup: ''Verfahrenskonzepte für die Übergangsmetallkatalysierten Synthesen von Ameisensäure und Dimethylformamid auf der Basis von Kohlendioxid.'' In: ''Chemie Ingenieur Technik.'' 75, 2003, S. 877–883, [[doi:10.1002/cite.200303221]].</ref> |
|||
Ved å la karbondioksid reagere med [[natriumfenolat]] oppnås gjennom [[Kolbe–Schmitt-reaksjon]]en [[salisylsyre]].<ref>H. Kolbe: ''Ueber Synthese der Salicylsäure.'' In: ''Liebigs Ann.'', 113 (1860), S. 125–127, [[doi:10.1002/jlac.18601130120]].</ref> |
|||
:[[Fil:Kolbe-Schmitt.png|left|500px|<!--Representasjon av salisylsyre av Kolbe–Schmitt-reaksjonen--> ]] |
|||
</br></br></br></br></br></br></br></br></br>Ved reaksjon med [[etylen]] blir [[etylen]] fremstilt. Dette skjer ved den såkalte ''[[OMEGA-Prosess]]en'' meget selektivt med vann for å gi til [[glykol]]. |
|||
Ved reaksjon med karbondioksid med en [[Grignard-forbindelse]] fører til dannelse av [[karbonsyre]], for eksempel: |
|||
:[[Fil:Carboxylation of alkyl magnesium halides.svg|left|<!-- Grignard reaksjon med CO<sub> 2 </ sub>--> ]] |
|||
</br></br></br></br></br></br></br></br></br></br>[[Telomerisering]] av karbondioksid med to molekyler av [[1,3-butadien]] under homogene [[Palladium]]-[[homogen katalyse|katalyse]] fører til dannelse av finkjemikalier som [[laktoner]] under milde reaksjonsbetingelser.<ref name="Behr" /> |
|||
:[[Fil:Telomerisation.svg|left|500px|<!--Eksempel på telomerisering av butadien med CO<sub>2</sub>-->]] |
|||
</br></br></br></br></br></br></br></br></br></br></br></br></br>[[Natriumkarbonat|Soda]] (natriumkarbonat) blir fremstilt i [[solvayprosessen]] av karbondioksid. Noen metallkarbonater slik som [[cerusitt]], blir produsert for eksempel ved reaksjon mellom metallhydroksyder og karbondioksid. Slike stoffer blir brukt som [[fargestoff]]. |
|||
På et høyt oljepris og lav strømpris, kan det i fremtiden være lønnsomt med utvinning av metan via [[Sabatier-prosessen]] fra karbon fra karbondioksid og hydrogen ved elektrolyse, for eksempel via energiproduksjon fra [[vindkraftverk]]er.<ref>Alexis Bazzanella, Dennis Krämer, Martina Peters: ''CO<sub>2</sub> als Rohstoff.'' In: ''Nachrichten aus der Chemie.'' 58, 2010, S. 1226–1230, [[doi:10.1002/nadc.201075752]].</ref> Ellers vil videre bruk av karbondioksid bli uøkonomisk av [[Entalpi|termodynamiske grunner]]. |
|||
=== Resirkulering av karbondioksid === |
|||
[[File:Kraftwerk Niederaußem.jpg|mini|[[Niederaussem kraftverk]] gjøres det forsøk med fangst av karbondioksid.]] |
|||
I tillegg til [[karbonfangst og -lagring]] går forskningen også i retning av å konvertere karbondioksid som dannes under forbrenning av fossile brensler til nyttbare forbindelser, og om mulig, dannelse av energibærere på nytt. For eksempel kan reduksjonsforbindelser slik som metanol<ref>{{Kilde bok | forfatter= Rudolf-Werner Dreier | tittel= Grünes Benzin aus Kohlenstoffdioxid | artikkel= | utgivelsesår= 13. Juni 2012 | forlag=Informationsdienst Wissenschaft | isbn= | url= }}</ref> og maursyre allerede fremstilles på denne måten.<ref>{{kilde www |url=http://www.wiwo.de/technologie/forschung/co2-recycling-der-klimakiller-als-rohstoff/6642990.html |forfatter=Sebastian Matthes, Susanne Donner |tittel=Der Klimakiller als Rohstoff |utgiver=Wirtschaftswoche online |arkivdato=2012-09-16 |besøksdato=2013-12-21}}</ref> |
|||
Tilsvarende er syntese av [[urea]] en mulighet. Et fransk forskerteam undersøkte [[katalyse|organisk katalyse]], ved konvertering til [[formamid]] eller dens derivater.<ref>{{Kilde bok | forfatter= Renate Hoer | tittel=Kohlendioxid-Recycling? | artikkel= | utgivelsesår= 8. November 2011 | forlag=Informationsdienst Wissenschaft | isbn= | url= }}</ref><ref>Christophe Das Neves Gomes, Olivier Jacquet, Claude Villiers, Pierre Thury, Michel Ephritikhine, Thibault Cantat: ''A Diagonal Approach to Chemical Recycling of Carbon Dioxide: Organocatalytic Transformation for the Reductive Functionalization of CO<sub>2</sub>.'' In: ''Angewandte Chemie.'' 124, 2012, S. 191–194, [[doi:10.1002/ange.201105516]].</ref> Sidens energi til å drive prosessen må tilføres, er ikke disse metodene egnet for økonomisk produksjon av energi. Forskere ved [[RWTH Aachen]] har utviklet en homogen katalytisk prosess for fremstilling av metanol fra karbondioksid og hydrogen under trykk med en spesiell ruthenium-fosfin-kompleks til stede i katalysatoren og reagenser i en løsning.<ref>Sebastian Wesselbaum, Thorsten vom Stein, Jürgen Klankermayer, Walter Leitner: ''Hydrogenation of Carbon Dioxide to Methanol by Using a Homogeneous Ruthenium-Phosphine Catalyst.'' In: ''Angewandte Chemie.'' 124, 2012, S. 7617–7620, [[doi:10.1002/ange.201202320]].</ref> Likeledes er en kontinuerlig fremgangsmåte for fremstilling av maursyre utviklet med et organometallisk ruthenium-kompleks, karakterisert ved at karbondioksid innehar en dobbelrolle både som reaktant og i en superkritisk form i den ekstraherende fase der maursyren dannes.<ref>Sebastian Wesselbaum, Ulrich Hintermair, Walter Leitner: ''Continuous-Flow Hydrogenation of Carbon Dioxide to Pure Formic Acid using an Integrated scCO2 Process with Immobilized Catalyst and Base.'' In: ''Angewandte Chemie.'' 124, 2012, S. 8713–8716, [[doi:10.1002/ange.201203185]].</ref> I en annen variant som er utviklet av en spansk forskningsgruppe, kan karbondioksid omdannes via en iridium-katalysert ''hydrosilyleringsreaksjon'' og fanges opp i form av silyl-formater. Fra dette kan maursyre lett skilles ut. Denne reaksjon som allerede har blitt realisert på i mindre skala, foregår under meget milde reaksjonsbetingelser, er meget selektiv og har høy omsetning.<ref>Ralte Lalrempuia, Manuel Iglesias, Victor Polo, Pablo J. Sanz Miguel, Francisco J. Fernández-Alvarez, Jesús J. Pérez-Torrente, Luis A. Oro: ''Effective Fixation of CO<sub>2</sub> by Iridium-Catalyzed Hydrosilylation.'' In: ''Angewandte Chemie.'' 124, 2012, S. 12996–12999, [[doi:10.1002/ange.201206165]].</ref> |
|||
I [[Niederaussem kraftverk]] utforske [[RWE]] og [[Brain AG]] hvordan mikroorganismer kan konvertere CO<sub>2</sub>.<ref>Stefan Pelzer: ''Maßgeschneiderte Mikroorganismen.'' In: ''Biologie in unserer Zeit.'' 42, 2012, S. 98–106, [[doi:10.1002/biuz.201210472]].</ref> |
|||
=== Andre bruksområder === |
|||
Karbondioksid var opp til 1950-årene, vanlig i brukt som [[bedøvelse]] for mennesker, spesielt i USA,<ref>A. A. LaVerne: ''Rapid coma technique of carbon dioxide inhalation therapy.'' In: ''Diseases of the nervous system'', 14.5 (1953), S. 141.</ref> og ble den gangen vurdert som svært tilfredsstillende. Etter dette er mer effektive [[anestetikum]] innført. |
|||
Imidlertid brukes fortsatt en metode med bedøving med karbondioksid før [[slakting]] av dyr.<ref>B. Nowak, T.V. Mueffling, J. Hartung: ''Effect of different carbon dioxide concentrations and exposure times in stunning of slaughter pigs: Impact on animal welfare and meat quality.'' In: ''Meat Science.'' 75, 2007, S. 290–298, [[doi:10.1016/j.meatsci.2006.07.014]].</ref> [[Gris]]er blir ført ned i grupper via en heis i en grop med en atmosfære som inneholder minst 80 % karbondioksid, hvor de mister bevisstheten. Denne prosedyren er kontroversielt og intensiv innsats gjøres for å forbedre metodene ut fra et [[dyrevern]]perspektiv.<ref>Roswitha Nitzsche: ''Verbesserung des Tierschutzes bei der Schweineschlachtung durch Neugestaltung des Zutriebs zur und in die CO<sub>2</sub>-Betäubungsanlage, Abschlussbericht, BLE – Forschungsvorhaben 05UM012/W'', o. J. (2008), Max Rubner – Institut, Institut für Sicherheit und Qualität bei Fleisch, Arbeitsbereich Technologie, Kulmbach [http://download.ble.de/05UM012_W.pdf Online PDF], 1,3 MB. Abgerufen am 22. Dezember 2013.</ref><ref name="TSB2012">ohne Verfasser: ''Systemimmanente Probleme beim Schlachten.'' Stand 21. August 2012, Deutscher Tierschutzbund e. V., Bonn 2012 [http://www.tierschutzbund.de/fileadmin/user_upload/Downloads/Hintergrundinformationen/Landwirtschaft/Systemimmanente_Probleme_beim_Schlachten.pdf Online PDF], 78 kB. Abgerufen am 22. Dezember 2013.</ref><ref name="TVT_2007">Tierärztliche Vereinigung für Tierschutz (Hrsg.): ''Tierschutzgerechtes Schlachten von Rindern, Schweinen, Schafen und Ziegen. Merkblatt Nr. 89'', 2007, Eigenverlag, Bramsche [http://www.tierschutz-tvt.de/merkblaetter.html#c98 Online]. Abgerufen am 22. Dezember 2013.</ref> Fisk blir lamslått ved å innføre gassformig karbondioksid eller ved å tilsette kullsyre i vannet.<ref>Lindsay G. Ross und Barbara Ross (Hrsg.): ''Anaesthetic and Sedative Techniques for Aquatic Animals. Third Edition,'' 2008, Blackwell Publishing, Oxford, ISBN 978-1-4051-4938-9, Kap. 9: ''Anaesthesia of Fish: II. Inhalation Anaesthesia Using Gases'', S. 127–135.</ref> Metoden med å bedøve slaktedyr med karbondioksid er underlagt ulike restriksjoner i forskjellige land, for eksempel bestemmelser for hvilke dyr som tillates bedøvd på denne måten. |
|||
Karbondioksid blir anvendt som avføringsmiddel i form av stikkpiller. Ved utvikling av natriumdihydrogenfosfat og natriumbikarbonat under oppløsning av stikkpillen blir karbondioksid frigjort og ekspanderer i tarmen, noe som i sin tur utløser avføringsrefleksen.<ref>T. Frieling: ''Diagnostik bei anorektalen Erkrankungen.'' In: ''Praxis'' 96.7 (2007): S. 243–247.</ref> |
|||
Karbondioksid virker som et [[gjødsel]], og brukes som det i [[drivhus]]. Grunnen til dette er mangelen på karbondioksid forårsaket av plantenes fotosyntese som forbruker CO<sub>2</sub>. Ved utilstrekkelig påfylling av frisk luft, spesielt om vinteren når ventilasjonen er lukket kan dette bli et problem. Karbondioksidet blir enten innført direkte som en ren gass eller som et forbrenningsprodukt av propan eller naturgass. Dette resulterer i en kobling av gjødsling og oppvarming. Den mulige økning av utbytte avhenger av omfanget av mangel på karbondioksid og i hvilken grad planter er utsatt for lys.<ref>S. C. Wong: ''Elevated atmospheric partial pressure of CO<sub>2</sub> and plant growth.'' In: ''Oecologia.'' 44, 1979, S. 68–74, [[doi:10.1007/BF00346400]].</ref> Karbondioksid blir anvendt i akvarier som et gjødsel for vannplanter. Ved tilførsel av organisk materiale øker karbondioksidinnholdet i vannet ved åndedrett på bekostning av oksygeninnholdet.<ref>{{kilde www |url=http://de.mongabay.com/fish/07.html |tittel=Pflanzenpflege in Aquarien |utgiver=[http://de.mongabay.com/ Mongabay.com] |besøksdato=2013-12-22}}</ref> |
|||
CO<sub>2</sub> anvendes for å fange blodsugende [[insekt]]er og [[smittebærer]]e. Disse bruker karbondioksid som forekommer i pusten til verten til å orientere seg etter. Det blir frigjort fra [[tørris]], fra gassflasker eller fra forbrenning av propan eller [[butan]]. Dette lokker insekter i nærheten til å bli dratt inn i et eget innsug.<ref>Y. T. Qiu, J. Spitzen, R. S. Smallegange, B. G. J. Knols: ''Monitor systems for adult insect pests and disease vectors.'' In: W. Takken & B.G.J. Knols (Hrsg.) ''Ecology and control of vector-borne diseases'', volume 1: ''Emerging pests and vector-borne diseases in Europe.'' Wageningen Academic Publishers, ISBN 978-90-8686-053-1, S. 329–353.</ref> |
|||
== Fysiologiske effekter og farer == |
|||
[[Fil:Main symptoms of carbon dioxide toxicity.png|mini|Symptomer på karbondioksidforgiftning. Ved nivåer på 1 % kan søvnighet oppstå, økes verdien til 3 % kan en føle redusert hørsel, økt hjertefrekvens og blodtrykk, enda høyere verdier fører til enda mer alvorlige symptomer og til slutt død ved rundt 8 %. {{byline|Mikael Häggström}}]] |
|||
Karbondioksid har skadevirkinger for dyr og mennesker om konsentrasjonen i innåndingsluften blir for stor. Den skadelige virkning er ikke bare basert på fortrengning av oksygenet i luften. [[EN-standard]]en EN 13779:2007 deler romluften inne i fire kvaliteter, avhengig av karbondioksidkonsentrasjonen: Verdier under 800 ppm regnes som god kvalitet, som moderat kvalitet regnes verdier mellom 800 og 1000 ppm (0,08 til 0,1 Vol %), mens verdier mellom 1000 og 1400 ppm anses som medium. For verdier over 1400 ppm er luftkvaliteten kategorisert som lav.<ref>UBA, Bekanntmachung des Umweltbundesamtes: ''Gesundheitliche Bewertung von Kohlendioxid in der Innenraumluft.'' In: ''Bundesgesundheitsblatt-Gesundheitsforsch-Gesundheitsschutz'' 51 (2008), S. 1358–1369.</ref> Til sammenligning er det globale gjennomsnittet av volumandel CO<sub>2</sub> i luften cirka 400 ppm, men det varierer regionalt, og er sterkt avhengig av tid og sesongvariasjoner. Terskel grenseverdi for daglig eksponering i åtte timer per dag er 0,5 %.<ref>{{kilde www |url=http://www.tyczka-co2.de/7_downloads/2_Datenblaetter/SDB-Kohlendioxid-tiefkalt-verfluessigt-UN2187.pdf |tittel=Sicherheitsdatenblatt – Kohlendioxid (tiefkalt verflüssigt) |utgiver=[http://www.tyczka.de/ Tyczka Kohlensäure] |archiv-url=https://web.archive.org/web/20131202223226/http://www.tyczka-co2.de/7_downloads/2_Datenblaetter/SDB-Kohlendioxid-tiefkalt-verfluessigt-UN2187.pdf |archiv-arkivdato=2013-12-02 |besøksdato=2013-12-21 |format=PDF}}</ref> Ved en konsentrasjon på 1,5 %, øker åndedrettens minuttvolum med mer enn 40 %. |
|||
Ved høy konsentrasjon av karbondioksid inntrer reduksjon, eller i verste fall opphør av de autonome reflekser som styrer åndedrettene, først inntreffer [[hyperventilering]] og til slutt [[apné]].<ref>{{kilde www |url=http://www.tk-online.de/tk/behandeln-a-z/r/rauchvergiftungen/148778 |tittel=Rauchvergiftungen/Vergiftungen durch Gase |utgiver=[http://www.tk-online.de/ Techniker Krankenkasse] |besøksdato=2013-12-21}}</ref> Fra cirka 5 % karbondioksid i innåndingsluften oppstår hodepine og svimmelhet, ved høyere konsentrasjoner akselerert hjertefrekvens ([[takykardi]]), det oppstår økt blodtrykk, [[Dyspné|åndenød]] og forstyrrelser av [[bevissthet]]en, såkalt ''CO<sub>2</sub>-narkose''. Konsentrasjon av karbondioksid på 8 % fører til døden i løpet av 30 til 60 minutter.<ref>{{kilde www |url=http://www.drk.de/erstehilfe/ehonline/lehrgang/vergift/co2_1.html |tittel=Erste Hilfe bei Kohlenstoffdioxid-Vergiftung |utgiver=[http://www.drk.de/ Deutsches Rotes Kreuz] |besøksdato=2013-12-21}}</ref><ref>{{kilde www |url=http://senseair.se/wp-content/uploads/2011/12/carbon_dioxide.pdf |tittel=Carbon Dioxide – Life and Death |utgiver=[http://www.senseair.se/ Sensair] |besøksdato=2013-12-21 |format=PDF}}</ref> |
|||
På grunn av at høye karbondioksidkonsentrasjoner forekommer i kjellere, siloer, brønner og kloakkummer, oppstår det stadig ulykker når personer oppholder seg slike steder.<ref name="Bau" /> Gjennom gjæringsprosesser oppstår det betydelige mengder karbondioksid, ved gjæring av for eksempel én liter eplemost oppstår om lag 50 liter gjæringsgass. Ofte blir flere mennesker offer for en gjærgassforgifting fordi hjelperen under et redningsforsøk selv puster inn karbondioksid og bli bevisstløs. Redningen av et offer i situasjoner med høy karbondioksidkonsentrasjon er bare mulig for profesjonelt redningspersonell med uavhengig [[åndedrettsvern]].<ref>Bodo Gorgaß, Friedrich W. Ahnefeld, Rolando Rossi: ''Rettungsassistent und Rettungssanitäter'', Springer Verlag, 1997, ISBN 3-540-21487-9, side. 305–314.</ref> |
|||
Hvis tilstrekkelig ventilasjon ikke er tilstede, er naturlige konsentrasjoner av luften ofte formet av naturlig karbondioksidkilder i grotter og gruveganger. For eksempel har den italienske grotten [[Grotta del Cane]] (hundegrotten) en karbondioksidkonsentrasjon på cirka 70 %.<ref>Ester Majo: ''I fenomeni vulcanici della grotta del Cane (Campi Flegrei) in rapporto alle variazioni atmosferiche.'' In: ''Bulletin Volcanologique.'' 4, 1927, S. 84–92, [[doi:10.1007/BF02719519]].</ref> |
|||
Karbondioksidkonsentrasjonen i blodet påvirker dets pH-verdi og således har det en indirekte virkning på oksygenbalansen. [[Bikarbonat-buffersystemet]], som er et [[karbonsyre]]-[[hydrogenkarbonat]]-buffer, utgjør omtrent 50 % av den totale bufferkapasiteten til blodet, som katalyseres av enzymet [[karbonsyreanhydrase]].<ref>David W. Christianson, Carol A. Fierke: ''Carbonic anhydrase: Evolution of the zinc binding site by nature and by design.'' In: ''Accounts of Chemical Research'' 29.7 (1996): S. 331–339, [[doi:10.1021/ar9501232]].</ref> |
|||
:<math>\mathrm{CO_2 + 2\ H_2O \ \rightleftharpoons \ H_3O^+ + HCO_3^-}</math> |
|||
Ved lavere pH-verdien vil dets oksygenbindendekapasitet avta. Ved det samme oksygeninnholdet i luften transport [[hemoglobin]] mindre oksygen. De såkalte ''[[bohreffekten]]'' og ''[[haldaneeffekten]]'' beskriver disse situasjonene.<ref>Peter Karlson: ''Karlsons Biochemie und Pathobiochemie''. Thieme-Verlag, Stuttgart 2005, ISBN 3-13-357815-4, side 38 ({{Kilde google books|ID=8Eu_Hy8aVzMC|side=38|keywords=Biochemie+Bohr-effekt|tittel=Auszug}}).</ref> En høy konsentrasjon av karbondioksid er også skadelig for planter. Som en indikatorplante brukes som mais, etter seks dagers eksponering med et karbondioksidnivå på 10 000 ppm får striper på bladene.<ref>M. Schwarz: ''Carbon toxicity in plants.'' In: ''International Symposium on Growing Media and Hydroponics'', 1997, S. 481 ([http://www.actahort.org/books/481/481_81.htm Abstract]).</ref> |
|||
== Økologiske betydningen == |
|||
[[Fil:Auto-and heterotrophs.svg|mini|Oversikt over fotosyntese og respirasjon]] |
|||
Planter og fotosyntetiske bakterier absorbere karbondioksid fra atmosfæren og omdanner den ved [[fotosyntese]] under påvirkning av lys og absorpsjon av vann, til i [[karbohydrater]] som [[glukose]]. Denne prosessen skjer frittgjør oksygen fra dekomposisjon av vann. De resulterende karbohydrater tjener som energikilder og byggemateriale for alle andre biokjemiske stoffer som [[polysakkarid]], [[nukleinsyre]]er og [[proteiner]]. Karbondioksid gir dermed råstoff for dannelsen av all biomasse i [[primærproduksjon]] til [[økosystem]]ene.<ref>Heinz-Gerhard Franck, Jürgen W. Stadelhofer: ''Sauerstoff und Kohlendioxid ? Schlüsselverbindungen des Lebens.'' In: ''Naturwissenschaften.'' 75, 1988, S. 585–590, [[doi:10.1007/BF00366470]].</ref> |
|||
Nedbrytning av biomasse etter [[celleånding]] er en reversering av prosessen med fotosyntese, med dannelse av karbondioksid og forbruk av oksygen.<ref>{{kilde www |url=http://www.pharmazeutische-zeitung.de/index.php?id=5750 |forfatter=Wolfgang Thüne |tittel=Kohlendioxid – Unverzichtbar für das Leben |utgiver=[http://www.pharmazeutische-zeitung.de/ Pharmazeutische Zeitung online] |arkivdato=2008 |besøksdato=2013-12-22}}</ref> Alle organismer i et økosystem ånder kontinuerlig, og er dermed avhengig av fotosyntesen som igjen er avhengig av tilgjengeligheten av lys. Dette fører til syklisk økning og reduksjon av karbondioksid i daglige og sesongmessige rytmer, avhengig av forskjellige lysintensitet. |
|||
I vann varierer også karbondioksidkonsentrasjonen i henhold til døgn- og årsrytmer. Karbondioksid og andre oppløste karbondsyrestoffer er i kjemisk likevekt, dette bestemmer det fremherskende pH-nivået i vannet i betydelig grad. Det kjemiske likevektsnivået av [[dissosiasjon (kjemi)|dissosiasjonen]] av [[ammonium]]/[[ammoniakk]], [[nitritt]]/[[salpetersyrling]], [[sulfider|sulfid]]/[[hydrogensulfid]] er igjen avhengig av pH-nivået. Sammensetningen av disse stoffene avgjør giftigheten for organismene som lever i vann.<ref>{{kilde www |url=http://www.spiegel.de/wissenschaft/natur/0,1518,667008,00.html |forfatter=Christian Schwägerl |tittel=Forscher fordern Säure-Limit für Ozeane |utgiver=[http://www.spiegel.de/ Der Spiegel] |arkivdato=2009-12-14 |besøksdato=2013-12-21}}</ref> |
|||
Dersom karbondioksid er oppbrukt ved fotosyntese i vannet, noe som indikeres av en pH-verdi nær 8,3, er noen arter av alger og vannplanter i stand til å utvinne den ønskede karbondioksid fra oppløste hydrogenkarbonat, slik at hydroksydioner frigjøres og gjør pH-nivået mer alkalisk. I næringsrike vann som karpedammer kan pH-verdien stige til 12, med tilhørende helsemessige konsekvenser for fisken, for eksempel kjertelnekrose hos karpefisk.<ref>Kurt Bauer: ''Zur Bedeutung der Kohlensäure in Karpfenteichen''. In: ''Österreichs Fischerei'', 44/1991, S. 49–64.</ref> |
|||
Forskere ved Senckenberg Biodiversität und Klima Forschungszentrum hadde i 2012 en felles studie med andre institusjoner, beregnet at [[sporeplanter]], altså lag av lav, alger og mose ved siden av nitrogen, binder cirka 14 milliarder tonn karbondioksid årlig. De binder like mye karbondioksid som det slippes årlig ut av skogbranner og brenning av biomasse over hele verden. Det er imidlertid ikke mulig å bekjempe [[klimaendringer]] ved hjelp av lag av sporeplanter, siden denne to-dimensjonale vegetasjonen lagrer klimagassen karbondioksid bare for noen få år.<ref name="DOI10.1038/ngeo1486">{{kilde bok |forfatter=W. Elbert, B. Weber, S. Burrows u. a. |tittel=Contribution of cryptogamic covers to the global cycles of carbon and nitrogen |Sammelutgiver=Nature Geoscience |Band=5 |Nummer=7 |arkivdato=2012-06-03 |Seiten=459–462 |DOI=10.1038/ngeo1486}}</ref><ref>{{Kilde bok | forfatter= Sabine Wendler | tittel=Unscheinbar und doch gewaltig: Flechten, Algen und Moose sind Großspeicher für Stickstoff und CO<sub>2</sub> | artikkel= | utgivelsesår= 4. Juni 2012 | forlag=Informationsdienst Wissenschaft | isbn= | url= }}</ref> |
|||
En betydning lagring og frigjøring av karbondioksid skjer i [[jord]]. Hvor sterk frigjøringen av organisk bundet karbon fra jord er er påvirket av de respektive miljøforhold og andre faktorer. Dette er for tiden i stor grad ukjent. Frigjøringen er imidlertid akselerert ved oppvarming, noe som har vært påvist i nyere studier og som kan ha en effekt på klimaet.<ref>{{Kilde bok | forfatter= Eberhard Fritz | tittel= Klimaerwärmung kann sich über Freisetzung von CO<sub>2</sub> aus Waldböden selbst verstärken | artikkel= | utgivelsesår= 11. Juni 2012 | forlag= Informationsdienst Wissenschaft | isbn= | url= }}</ref> Ved å indikere størrelsen av CO<sub>2</sub>-utslippene kan ulike prosesser bli sammenlignbare rent energimessig og økologisk. Disse vil bli konvertert til utslipp av karbondioksid fra fossile brensler. |
|||
== Deteksjon og kvantifisering == |
|||
En enkel påvisning av karbondioksid er oppnådd med en vandig [[kalsiumhydroksid]]oppløsning. For dette formål blir gassen som skal undersøkes innført i oppløsningen. Inneholder gassen karbondioksid, reagerer den med kalsiumhydroksid til vann og [[kalsium]] (kalk), som utfelles som et hvitt, fast stoff og oppløsningen blir uklar. |
|||
:<math>\mathrm{CO_2 + Ca(OH)_2 \longrightarrow H_2O + CaCO_3 \downarrow}</math> |
|||
Med barytvann, en oppløsning i vann med [[bariumhydroksid]] blir testen mer sensitive, ettersom bariumkarbonat er mindre oppløselig enn kalsiumkarbonat. |
|||
:<math>\mathrm{CO_2 + Ba(OH)_2 \longrightarrow H_2O + BaCO_3 \downarrow}</math> |
|||
I vandig oppløsning er karbondioksid [[titrering]] med [[Normalitet (kemi)|0,1 N]] Natronlut til pH-verdien 8,3, fargeforskyvningen av indikatoren [[fenolftalein]]. Målingen av [[alkalitet|syrebindende kapasitet]], pH-nivå og elektriske ledningsevne, eller ionestyrken tillater beregning av karbondioksidinnholdet fra disse parameterne som følge av dissosiasjonlikevekt av karbonsyre. |
|||
Severinghaus-elektroden er en pH-elektrode med en bufferløsning av natrium, bestemmer karbondioksidkonsentrasjonen av en løsning ved å måle pH-forandring.<ref>{{kilde www |url=https://data.epo.org/publication-server/getpdf.jsp?cc=EP&pn=1929938&ki=A1 |forfatter=Adrianus Kleinleugenmors |tittel=Vorrichtung zur Messung des Partialdrucks von Kohlendioxid |utgiver=Europäisches Patent |arkivdato=2006-12-04 |besøksdato=2013-12-21}}</ref> |
|||
:<math>\mathrm{CO_2 + H_2O \ \rightleftharpoons \ H_2CO_3 \rightleftharpoons \ HCO_3^- + H^+} </math> |
|||
Karbondioksid kan etter [[Infrarød spektroskopi|infrarød]]- eller [[Raman-spektroskopi]], hvorved de asymmetriske strekkervibrasjonene samt vippevibrasjoner er infrarød-aktive, mens det symmetriske strekkevibrasjonen er Raman-aktivt ved et bølgetall på 1480 cm<sup>-1</sup> Raman-aktiv.<ref>Arthur Adel, David Dennison: ''The Infrared Spectrum of Carbon Dioxide. Part I.'' In: ''Physical Review.'' 43, 1933, S. 716–723, [[doi:10.1103/PhysRev.43.716]].</ref> Instrumentet som brukes til dette kalles NDIR-sensor (non-dispersive infrared sensor). |
|||
== Se også == |
|||
* [[CO2-håndtering|CO<sub>2</sub>-håndtering]] |
|||
* [[Drivhusgass]] |
|||
* [[Global oppvarming]] |
|||
* [[Kvotehandel]] |
|||
== Referanser == |
== Referanser == |
||
<references/> |
<references /> |
||
== Litteratur == |
|||
* Hans-Otto Pörtner: [http://www.wbgu.de/fileadmin/templates/dateien/veroeffentlichungen/sondergutachten/sn2006/wbgu_sn2006_ex04.pdf ''Auswirkungen von CO<sub>2</sub>-Eintrag und Temperaturerhöhung auf die marine Biosphäre.''] (PDF; 1,3 MB) |
|||
* Jens Soentgen, Armin Reller: ''CO<sub>2</sub> – Lebenselixier und Klimakiller.'' Oekom-Verlag, München 2009, ISBN 978-3-86581-118-9. |
|||
* James Newton Butler: ''Carbon Dioxide Equilibria and Their Applications.'' Lewis Publishers, 1991, ISBN 0-87371-624-8. |
|||
* Martin M. Halmann, Meyer Steinberg: ''Greenhouse Gas Carbon Dioxide Mitigation: Science and Technology.'' CRC Press Inc, 1998, ISBN 1-56670-284-4. |
|||
* Martin M. Halmann: ''Chemical Fixation of Carbon Dioxide Methods Recycling: Methods of Recycling CO<sub>2</sub> into Useful Products.'' CRC Press Inc, 1993, ISBN 0-8493-4428-X. |
|||
== Eksterne lenker == |
== Eksterne lenker == |
||
{{Commons|Carbon dioxide|Kohlenstoffdioxid}} |
|||
* [http://mdgs.un.org/unsd/mdg/SeriesDetail.aspx?srid=749&crid= FN - liste over CO2-utslipp per land]. |
|||
{{Wiktionary}} |
|||
* [http://ec.europa.eu/environment/climat/emission/pdf/public_citl_apr2008.xls EU – liste over CO2-utslipp per installasjon]. |
|||
{{Autoritetsdata}} |
|||
* [http://cdiac.ornl.gov/ Carbon Dioxide Information Analysis Center] U.S. Department of Energy |
|||
* [http://carma.org/ Carbon Monitoring for Action (CARMA)] – Database med informasjon om karbondioksidutslipp fra 50 000 kraftverk og 4000 energiselskaper over hele verden. |
|||
[[Kategori:Gasser]] |
[[Kategori:Gasser]] |
||
Sideversjonen fra 22. jan. 2017 kl. 16:35
 Strukturformel til karbondioksid med båndlengde | |||||
| |||||
| Andre navn | |||||
| Tørris | |||||
| Identifikatorer | |||||
| CAS-nummer | |||||
|---|---|---|---|---|---|
| ChemSpider | |||||
| EU-nummer | |||||
| UN-nummer | 1013 (gass), 1845 (fast) | ||||
| KEGG | |||||
| MeSH | |||||
| ChEBI | |||||
| RTECS | FF6400000 | ||||
| ATCvet-kode | ingen | ||||
| SMILES | O=C=O | ||||
| Gmelin | 989 | ||||
| 3DMet | |||||
| Kjemiske egenskaper | |||||
| Formel | CO2 | ||||
| Molar masse | 44,01 g/mol g/mol | ||||
| Utseende | Fargeløs gass | ||||
| Tetthet | 1,977 (gass ved1 atm og 0 °C) kg/m3 | ||||
| Smeltepunkt | ikke ved normalt trykk °C | ||||
| Kokepunkt | ikke ved normalt trykk °C | ||||
| Damptrykk | 5,73 Mpa ved 20 °C | ||||
| Sublimasjon | −78,5 °C; 194,7 K (1 atm) | ||||
| Løselighet | 1,45 g/l ved 25 °C, 100 kPa | ||||
| pKa | 6,35, 10,33 | ||||
| Mag. sus. | -20,5·10−6 cm3/mol | ||||
| nD | 1,0004493 (0 °C, 101,325 kPa) | ||||
| Viskositet | 0,07 cP ved −78,5 °C | ||||
| Dipolmoment | 0D | ||||
| Struktur | |||||
| Krystallstrukt. | trigonal | ||||
| Molekylær form | Lineært | ||||
| Termokjemiske egenskaper | |||||
| Dannelsesentalpi ΔfH | −393,5 kJ·mol−1 | ||||
| Molar entropi S | 214 J·mol−1·K−1 | ||||
| Varmekapasitet, C | 37,135 J/K mol | ||||
| Farer | |||||
| Datablad | EcoOnline | ||||
| NFPA-H | 1 | ||||
| NFPA-F | 0 | ||||
| NFPA-R | 0 | ||||
| GHSP-piktogram | Mal:GHS-Piktogramme | ||||
| Tillatt eksponeringsgrense i USA | TWA 5000 ppm (9000 mg/m3 | ||||
| Relatert | |||||
| Andre anioner | Karbondisulfid Karbondisulfid | ||||
| Andre kationer | Silisiumdioksid Germaniumdioksid Tindioksid blyoksid | ||||
| Andre funksjoner | Karbonmonoksid Karbonsuboksid Dikarbonmonoksid Karbontrioksid | ||||
| Andre lignende forbindelser | Karbonsyre Karbonylsulfid | ||||
Karbondioksid er en kjemisk forbindelse av karbon og oksygen med kjemisk formel CO2, den er ikke-brennbart, sur, fargeløs og luktfri gass. Den løser seg lett opp i vann, hvor den også forekommer ofte, for eksempel i det som i dagligtale kalles kullsyre i leskedrikker, men som er en uriktig betegnelse. Med metalloksider eller hydroksid, kan karbondioksid danne to typer salter, nemlig karbonater og hydrogenkarbonat.
CO2 er en viktig del av det globale karbonkretsløpet, samt en naturlig del av luften som en viktig drivhusgass i atmosfæren: Menneskelig aktivitet, spesielt forbrenning av fossile energikilder, har økt andelen parts per million (ppm) CO2 i atmosfæren fra cirka 280 før starten av industrialiseringen til cirka 400 ppm i 2015. Denne tendensen er fortsatt stigende.[1] Denne økningen resulterer i en forsterkning av den naturlige drivhuseffekten, som i sin tur er årsaken til dagens globale oppvarming.[2]
Ved forbrenning av stoffer som inneholder karbon med tilstrekkelig oksygen oppstår CO2. Gassen oppstår også i organismer og levende vesener som et produkt av celleånding. Planter, algerer og noen bakterier og arkebakterier konverterer CO2 etter fiksering i biomasse. Under fotosyntesen skapes glukose fra uorganisk CO2 og vann.
CO2 kan være giftig, men konsentrasjonen i luften er langt fra nok til at det er skadelig. Den har et bred spektrum av teknisk anvendelser. I kjemiske industri brukes den for eksempel ved fremstilling av urea. I fast form som tørris er CO2 mye brukt som kjølemiddel, og som såkalt superkritisk karbondioksid blir brukt som løse- og ekstraheringsmiddel.
Historie

Karbondioksid var en av de første gassene som fikk et navn. På 1600-tallet observerer den flamske kjemikeren Jan Johannes van Helmont at massen av trekull ble redusert under forbrenningen, ettersom massen av den gjenværende aske var mindre enn det kull som ble brukt. Hans tolkning var at resten av kullet hadde blitt omgjort til et usynlig stoff som han kalte gass eller Spiritus Sylvestre («Vild ånd»).[3]
Egenskapene til karbondioksid ble undersøkt mer grundig av den skotske legen Joseph Black. Han oppdaget i 1754 at når kalsium blandes i en løsning med syrer, frigjøres en gass som han kalte fixed air («fiksert/etablert luft»).[4] Han innså at denne gassen var tyngre enn luft og ikke opprettholder forbrenningprosesser. Ved injisering av denne gass i en oppløsning av kalsium så han at en fellingsreaksjon skjedde. Dette fenomen fikk ham til å forstå at karbondioksid oppstår i pusting hos pattedyr, og frembringes av mikrobiologisk fermentering. Hans arbeid viste at gasser kan være involvert i kjemiske reaksjoner, og bidro til at en vente seg bort fra teorien om flogiston.[5]
Joseph Priestley lyktes i 1772 med den første produksjon av brus ved å tilføre svovelsyre i en kalkløsning, for deretter å oppløse den resulterende karbondioksid i en mugge med vann.[6] I 1823 lyktes Humphry Davy og Michael Faraday med å gjøre karbondioksid om til en væske ved å øke trykket.[7] Den første beskrivelsen av fast karbondioksyd kommer fra Charles Thilorier, i 1834 trykksatt han en beholder med flytende karbondioksid. Da han åpnet beholderen fant han ut at en spontan fordampning finner sted, noe som fører til avkjøling slik at også en del faststoff av CO2 ble dannet.[8]
Forekomst
Karbondioksid er i atmosfæren, i hydrosfæren, i litosfæren og biosfæren. Karbon utveksles mellom disse sfærene i stor grad i form av karbondioksid. I atmosfæren var det i 2015 rundt 830 gigatonn (830 000 000 000 tonn) karbon i form av karbondioksid.[9] hydrosfæren inneholder cirka 38 000 gigatonn med karbon i form av fysisk oppløst karbondioksid, samt oppløst hydrogenkarbonater og - karbonater. Litosfæren omfatter den klart største andelen av kjemisk bundet karbondioksid. Karbonatbergarter som kalsitt og dolomitt inneholder cirka 60 millioner gigatonn karbon[10] I tillegg til dette kommer innholdet av karbon i permafrostområder som tundraen i Arktis og Antarktis ved polområdene, boreal barskog eller fjellområder som lagrer store mengder karbon.[11][12]
Forekomst i atmosfæren


Utdypende artikkel: Liste over land etter karbondioksidutslipp
Karbondioksid er en sporgass i atmosfære. Konsentrasjonen i 2013 er lokalt overskred terskelen på 400 ppm (parts per million, deler per million), som ble målt av National Oceanic and Atmospheric Administration (NOAA) i USA på Mauna Loa, Hawaii.[13][14][15]
En studie publisert høsten 2016 i tidsskriftet Science kunne for første gang fremvise en lineær sammenheng mellom utslipp av CO2 og smelting av sommerisen i Arktis: «Et tonn CO2 = -3 km3 sommeris».[16]
Den totale massen av karbondioksid i atmosfæren er cirka 3000 gigatonn eller cirka 800 gigatonn karbon (forholdet mellom molar masse av CO2 til C er 44:12). Konsentrasjonen varierer både med årstidene og lokalt, spesielt på bakken. I urbane områder er konsentrasjonen generelt høyere i lukkede rom, der kan konsentrasjonen være opp til ti ganger høyere enn gjennomsnittet.[17]
Karbondioksid absorberer noe av varmestrålingen fra solen (den infrarøde), mens den kortbølgede del av solstrålingen kan passere nesten uhindret. Et absorberende legeme avgir også varmestråling i henhold til sin temperatur. Disse funksjonene gjør karbondioksid til en såkalt klimagass. Etter vanndamp utgjør karbondioksid den andre store klimagassen i forhold til sin mengdeandel i atmosfæren, selv om den spesifikke virkningen av metan og ozon er høyere. Alle klimagasser sammen øker den gjennomsnittlige temperaturen på jordoverflaten på grunn av den naturlige drivhuseffekten fra cirka -18 °C til +15 °C. Karbondioksid har en relativt stor andel av den samlede effekten og dermed bidrar dermed til å gjøre klimaet vennlig for livet på jorden.[18]
Atmosfærens innhold av karbondioksid har vært utsatt for store svingninger i løpet av historien, noe som har hatt ulike biologiske, kjemiske og fysiske årsaker. For 500 millioner år siden var karbondioksidkonsentrasjonen omtrent 20 ganger høyere enn dagens nivå.[19] Verdien sank jevnt og var i jura omlag fire til fem ganger sin nåværende verdi. Siden da har verdien falt videre. I alle fall de siste 800 000 år har andelen alltid vært under 300 ppm.[20][21] Konsentrasjon av karbondioksid i den siste 10 000 år har holdt seg relativt stabilt på 300 ppm. Balansen i karbonkretsløpet har dermed vært i likevekt over dette tidsrommet. Fra begynnelsen av den industrielle revolusjon på 1800-tallet har karbondioksidinnholdet i atmosfæren økt. Den nåværende konsentrasjonen er trolig den høyeste på flere hundre tusen år.[22][23][24][25][26]
I perioden 1960 til 2005 økte karbondioksidinnholdet med 1,4 ppm per år.[27]

De antropogene, altså menneskeskapte, utslipp av karbondioksid, er cirka 36,3 gigatonn per år.[27] Dette utgjør bare en liten andel av de fra naturlige kilder av karbondioksid som er på cirka 550 gigatonn per år.[28] Men fordi det naturlige karbonsluket opptar samme mengde CO2 hold karbondioksidkonsentrasjonen seg relativt konstant før industrialiseringen. Den ekstra karbondioksiden er omtrent halvparten av biosfærens og av verdenshavenes (som fører til forsuring) opptak, slik at de nå absorberer mer karbondioksid enn de avgir.[29] Den andre halvparten av karbondioksidutslippene forblir i atmosfæren, hvor det fører til målbar økning i konsentrasjonen. Denne kurven som viser økt karbondioksidkonsentrasjon er beskrevet av Charles David Keeling, og den såkalte Keeling-kurve er oppkalt etter ham. Denne ble første gang vist i begynnelsen av 1960-årene.
Det er generelt akseptert at det er en statistisk signifikant menneskeskapt innflytelse på klimaet, som er delvis ansvarlig for den global oppvarming. Denne oppvarmingen har svært sannsynlig for en stor del sin årsak i økningen i drivhuseffekten på grunn av utslipp av klimagasser.[30] Det karbondioksid som produseres i tillegg har en andel på cirka 60 % av drivhuseffekten.[31][32]
I mars 2015 ble det i henhold til National Oceanic and Atmospheric Administration (NOAA) for første gang målt mer enn 400 ppm CO2 i jordens atmosfære.[33]
Forekomst i verdenshavene
Vannet i havet inneholder karbondioksid i oppløst form, så vel som karbondioksid i likevekt med hydrogenkarbonater og karbonater. Den oppløste mengde varierer med årstidene, fordi den avhenger av temperaturen og saltinnholdet i vannet: Kaldt vann oppløser mer karbondioksyd enn varmt. Fordi kaldt vann har større tetthet, synker karbondioksidinnholdet i havene på dypere lag. Bare ved trykk over 300 bar og temperaturer over 120& nbsp;°C (393 K) er situasjonen anderledes, som i nærvær av dyp med geotermiske skorsteiner.[34]
I havet er det omtrent 50 ganger mer karbon enn inneholdet i atmosfæren. Havet fungerer som en stort karbonsluk og absorberer cirka en tredjedel av den frigitte mengden karbondioksid fra menneskelig aktivitet.[35] I de øvre lag av verdenshavene er karbondioksid delvis bundet av fotosyntesen. Med ved økende oppløsning av karbondioksid senkes alkaliteten til saltvann, og det er fryktet at dette vil påvirke dannelsen av skjell hos organismer.[36] På den annen side er det bevis for at økt karbondioksid konsentrasjon stimulerer noen arter til økt skjellproduksjon.[37]
Forekomst i ferskvann
Gjennom spesielle geologiske forhold kan ferskvann oppta betydelige mengder med karbondioksid, som vann fra mineralkilder eller i innsjøer i utdødde vulkaner, kalt Maarer. I sjeldne tilfeller inntreffer naturkatastrofer på grunn karbondioksid. I 1986 inntraff en katastrofe på Lake Nyos i Kamerun.[38] Innsjøen ligger i et gammelt vulkankrater i Oku-vulkansk område. Et magmakammer strømmet ut i innsjøen, og karbondioksid ble oppløst i vannet slik at det ble mettet. Sannsynligvis forårsaket et jordras at store mengder karbondioksid fra innsjøen ble sluppet ut, noe som drepte omkring 1700 innbyggere og 3500 dyr i omkringliggende landsbyer. I 1984 inntraff en liknende katastrofe ved Lake Monoun der vannet ble mettet med karbondioksid på grunn av en slik hendelse. Under denne spontane frigjøringen av karbondioksid omkom 37 mennesker. Dessuten har Kivusjøen i Sentral-Afrika høye konsentrasjoner av oppløste gasser på dypt vann. Det er anslått at rundt 250 km³ karbondioksid er oppløst i denne innsjøen.[39]
Forekomst utenom jorden

Atmosfæren på Venus består av cirka 96,5 % karbondioksid, og har en massen på cirka 90 ganger Jordens atmosfære, med et trykk på 90 bar. Det høye karbondioksidinnholdet er en årsak til den sterke drivhuseffekten på planeten. Videre i forhold til jorden har den gjennomsnittlig en 41 millioner kilometer kortere avstand fra solen, noe som resulterer i en overflatetemperatur på cirka 480 °C.[40] Karbondioksid er også den viktigste delen av atmosfære på Mars, som utgjør rundt 95 % av innholdet.[41] På polene til Mars er den atmosfærisk delen av karbondioksid delvis bundet som tørris. Det atmosfæriske trykk er svært lavt, bare cirka syv millibar, noe som fører til at dens drivhuseffekten bare gir en økning av temperaturen på om lag 5 °C. Dette til tross for det høye karbondioksidinnhold. Atmosfærene til de ytre planetene i solsystemet, samt til deres satellitter, inneholder også karbondioksid. Opprinnelsen til denne er knyttet til konsekvensene av kometer som Shoemaker–Levy 9 og kosmisk støv.[42][43] Med instrumenter som Hubble-teleskopet har NASA funet eksoplaneter som HD 189733 b med karbondioksid.[44]
Karbondioksid er funnet både i det interstellare rom, i den protoplanetarisk skive og rundt unge stjerner.[45] Dannelsen skjer ved overflatereaksjoner med karbonmonoksid og oksygen til vann- og ispartikler ved temperaturer rundt -123 °C (150 K). Ved fordampning av isen frigjøres karbondioksid.[46] I det frie rommet mellom, er konsentrasjonen forholdsvis lav, ettersom vann og karbonmonoksid er dannet ved reaksjoner med atomært og molekylært hydrogen.[47]
Utvinning og produksjon
Karbondioksid som produseres ved forbrenning av karbonholdige brennstoffer, spesielt fossile energikilder. Totalt blir omtrent 36 milliarder tonn karbondioksid per år frigjort i verden, og dette blir sluppet ut i atmosfæren. Prosesser for karbonfangst og -lagring er for tiden (2016) i begynnelsen av sin utvikling, og er ennå ikke klar for serieproduksjon. Metodenes effektivitet og lønnsomhet, spesielt i sammenheng med bærekraftige energisystemer, blir vurdert kritisk.[48]
Karbondioksid dannes ved reaksjon mellom karbon og oksygen:
Teknisk sett er karbondioksid generert når en brenner koks med luftoverskudd. Ved kullforgassing og dampreforming av naturgass, er karbondioksid et produkt av vann-gass-skiftreaksjonen i syntesegassproduksjon:
For anvendelse i Haber–Bosch-prosessen og metanolproduksjon blir syntesegassen vasket, for eksempel ved rectisolmetoden, slik at karbondioksid blir produsert i store mengder i meget ren form.[50][51] Karbondioksid oppstår som et biprodukt ved kalkbrenning. Ved påfølgende rensing ved dannelsen av kaliumkarbonat til bikarbonat og påfølgende utslipp ved oppvarming, blir om lag 530 millioner tonn gjenvunnet hvert år.
For anvendelse i et laboratorium kan karbondioksid frigjøres fra kalsium og saltsyre, for eksempel i et Kipp's apparat. Enheten var tidligere i mye brukt i laboratorier, men metoden blir nå sjelden brukt, siden karbondioksid er tilgjengelig i gassflasker eller som tørris.[52]
Egenskaper

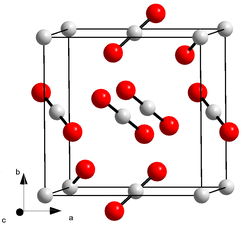
Fysiske egenskaper
Karbondioksid opptrer ved normalt trykk som et fast stoff ved temperaturer under -78,5 °C. Dette stoffet kalles tørris. Hvis dette blir oppvarmet vil det ikke smelte, men blir sublimert direkte til gassform.
Trippelpunkt der de tre fasene av faststoff, væske og gass finnes ved termodynamisk likevekt, er ved en temperatur på -56,6 °C og et trykk på 5,19 bar.[53]
Den kritiske temperaturen er 31,0 °C, det kritiske trykket 73,8 bar og den kritiske tettheten 0,468 g/cm³.[53] Under den kritiske temperaturen kan karbondioksid komprimeres ved trykkøkning til en fargeløs væske.[54] Ved romtemperatur kreves et trykk på cirka 60 bar for at CO2 skal være i væskeform.
Fast karbondioksid krystalliserer i kubisk krystallstruktur i romgruppe Pa-3 (romgruppe nummer 205) med gitterparameteren a = 562,4 pm.[55]
Karbondioksid absorberer elektromagnetisk stråling hovedsakelig i regionen av spektret av infrarød, noe som gir molekylær vibrasjoner. Dette er selve årsaken til stoffets egenskap som klimagass.
Dens løselighet i vann er forholdsvis høy. Ved 20 °C under normalt trykk er metning i likevekt med ren karbondioksid ved 1688 mg/l. For sammenligning er løseligheten av oksygen eller nitrogen som følger: I rent oksygen er metningen allerede nådd ved 44 mg/l og ved ren nitrogen ved 19mg/l.[56] I standard tilstand er tetthet av karbondioksid 1,98 kg/m³.[57]
Molekylære egenskaper
Karbondioksidmolekylet er lineært, det vil si at alle tre atomer ligge på en rett linje. Karbonet er bundet til to oksygenatomer med dobbeltbindinger, begge oksygenatomene har to frie elektronpar. Karbon-oksygen avstanden er 116,32 pm[54] Karbon-oksygenbindinger er polarisert på grunn av de forskjellige elektronegativitetene til karbon og oksygen. Imidlertid vil de elektriske dipolmomenter oppheve hverandre utover på grunn av symmetri, slik at molekylet ikke har noe elektrisk dipolmoment.
Kjemiske egenskaper

Oppløst i vann danner karbondioksid karbonsyre (H2CO3), hvor mer enn 99 % av karbondioksidet bare er fysisk oppløst. Derfor er den vandige løsningen svakt sur. Karbonsyre som sådan, og den oppløste karbondioksid, er i en likevekt med deres dissosiative stoffer hydrogenkarbonat (bikarbonat, HCO3-) og karbonat (CO32-), som er i et pH-verdi avhengig forhold til hverandre. I vann ligger denne likevekten hovedsakelig mot siden av karbondioksid og bare i liten grad dannes det hydrogenkarbonationer.
Dersom oksoniumioner (H3O3) som er dannet i løpet av dissosiasjon blir oppfanget ved tilsetning av en alkalisk oppløsning med hydroksidioner (OH-), idet mengdeforholdet skifter i favør av karbonater.
Karbondioksid er en meget svak oksidasjonsmiddel. Uedle metaller som for eksempel magnesium fungerer som et sterk reduksjonsmiddel, reagere i med karbondioksid til å danne karbon og metalloksider:[58]
På grunn av den positive partialladningen til karbon reagerer karbondioksid som elektrofil i karboksylering av karbon nukleofiler slik som metall-alkylider eller alkylmagnesium for å danne en karbon-karbon-binding. Med karbondioksid reagerer med fenolsyre med reaksjonsstoffet fenolkarboksylsyrer.
Anvendelse
Karbondioksid brukes i industrien til mange forskjellige formål. Det er billig, ikke-brennbart og anvendes som komprimert gass, i flytende form, som tørris eller i superkritisk fase. Den kjemiske industrien anvender karbondioksid som et råmateriale for kjemiske synteser.
Bruk i næringsmiddelteknologi

I drikker som inneholdt karbondioksid stimuleres reseptorceller i munnen, noe som har en forfriskende effekt. For drikker som øl eller champagne kommer karbondioksid fra gjæringsprosessen. I andre drikker som limonade eller sodavann blir CO2 kunstig tilsatt, eller det benyttes naturlig mineralvann som inneholder CO2. Ved produksjon av slike varer blir karbondioksid pumpet inn i drikken under høyt trykk. Der cirka 0,2% av vannet reagerer med karbondioksid og danner karbonsyre, mens den største del går i oppløsning som en gass i vannet. Som tilsetningsstoff kalles karbondioksid for E 290.[59]
Gjær utvikler ved gjæring av sukker karbondioksid som benyttes som hevemiddel ved fremstilling av deig. Bakepulver er en blanding av natriumbikarbonat og et surt salt er også brukt som et hevemiddel, men gir ikke karbondioksid.[60]
Ved produksjon av vin brukes tørris som kjølemiddel for å avkjøle nylig plukket druer uten fortynning med vann, noe som vil kunne skape spontan gjæring. Vindyrkerne i Beaujolais i Frankrike bruker kullsyregjæring for å produsere "Beaujolais Primeur .[61]
Ved lagring av frukt og grønnsaker spiller temperaturen en viktig rolle, men det samme gjør også sammensetningen av atmosfæren der disse produktene oppbevares. Hos fruktprodusenter og butikker kan epler som lagres i kontrollerte omgivelser være holdbare i flere tiår. Kunnskapen om at moden frukt forbruker oksygen og avgir karbondioksid, og at en atmosfære uten oksygen vil føre til at modningen stopper, går tilbake til begynnelsen av 1800-tallet. På 1930-tallet ble det for første gang konstruert et lager der innholdet av oksygen og karbondioksid i luften kontrolleres, dette ble utprøvd i Storbritannia.[62] Den økonomiske betydningen av nøyaktig kontrollerte atmosfærer for fruktlagring er stor. Med tilsetning av karbondioksid til atmosfæren kan holdbarheten forlenges med flere måneder, dermed blir en mindre avhengigheten av import fra varmere strøk om vinteren og våren. På den annen side kan uriktig tilsetning av karbondioksid føre til feil i fruktkjøttet, dermed kan et helt lager eller en containertransport bli verdiløs.[63] De biokjemiske prosessene som fører til den forsinkede modning av frukt er ennå ikke forstått. For tiden er det antatt at både bremsing av modningsprosessen og dannelsen av forskjellige feil forårsaket av stressresponser blir styrt på cellenivå.[62]
Frukt, grønnsaker og sopper som i detaljhandel blir pakket i folie,[64] blir gjerne utstyrt med en beskyttende atmosfære, dette for å forlenge holdbarheten. Dette gir også en beskyttelse av friskheten på vei til forbrukeren. I dag blir også kjøtt, fisk og sjømat, pasta, bakervarer og meieriprodukter solgt i slik forpakning. Typiske nivåer er 20 % karbondioksid for storfekjøtt, 50 % for storfekjøtt, svinekjøtt og pasta, 60 % for bakervarer og hele 80 % for fisk. En emballasje med bare karbondioksid unngås. Dette fordi det ville kunne føre til utviklingen av sykdomsfremkallende anaerobe bakterier, og i mange tilfeller påvirke farge og smak på produktene. Bestemmelse av optimal beskyttende atmosfære for et produkt er gjenstand for intens forskning i matindustrien.[65][66]
Superkritisk karbondioksid har høy løselighet for upolare stoffer og kan erstatte giftige organiske Løsemidler. Det brukes som ekstraksjonsmiddel, for eksempel for utvinning av naturstoffer som koffein ved fremstilling av koffeinfri kaffe.[67]
Teknisk anvendelse
Karbondioksid anvendes ved brannslokking på grunn av sin egenskap til å fortrenge oksygen, spesielt i brannslokningsapparater og automatiske slukkeanlegg. CO2-brannslukningssystemer anvendes for å beskytte siloer eller lagerrom for brannfarlige væsker ved å fylle hele rommet med karbondioksid. Dette har imidlertid ført til gjentatte ulykker, med kvelning til følge.[68] En studie av US Environmental Protection Agency (EPA) raporterte om 51 ulykker i tidsrommet 1975-1997 med 72 dødsfall og 145 skadete på grunn av slike anlegg.[69]
Karbondioksid brukes som kuldemedium i bilbransjen og stasjonære klimaanlegg, som industriell kjøling, supermarkeder og transportkjøling og drikkemaskiner.[70] Den har en stor volummessig kjølekapasitet og dermed en høy effektivitet for et gitt volum. Karbondioksid har en lav miljøbelastning, ettersom det globale oppvarmingspotensialet bare er en brøkdel av de vanlige kjølemedier som brukes i dag. Det har heler ingen ozonnedbrytende potensiale. Karbondioksid blir anvendt i sentralvarmesystemer og oppvarming i kjøretøyer.[71] I gasskjølte atomreaktorer av type som Advanced Gas-cooled Reactor blir karbondioksid brukt som kjølemiddel.
Karbondioksid blir anvendt som en inertgass innenfor sveiseteknologi, enten i ren form eller som et tilsetningsstoff sammen med argon eller helium. Ved høye temperaturer er CO2 termodynamisk ustabil derfor er det ikke er referert til som lite reaksjonsvillig, i stedet blir det da omtalt som en aktiv gass.[72]

I en såkalt karbondioksidlaser strømmer kontinuerlig en lasergass gjennom utladningsrøret, denne består av en blanding av nitrogen, helium og karbondioksid. I tillegg til den vanlige faste laseren, er det en av de mest bruket industrielt gasslasere med ytelse mellom 10 W og 20 kW. Virkningsgraden er omtrent 10 til 20 %.[73]
I flytende form omsettes karbondioksid i gassflasker. Det finnes to typer: flasker med stigerør for uttak av flytende karbondioksid og flaske uten stigerør for uttak av karbondioksid i gassform.[74] Begge må være i vertikal posisjon ved transport. Flasken uten stigerør anvendes med trykkreduksjonsventil, mens den med stigerør hovedsakelig drives uten. Så lenge det fremdeles er flytende karbondioksid i trykkflasken, er det indre trykket bare avhengig av temperaturen. En måling av fyllingsnivået er derfor bare mulig via veiing for begge flasketypene. Kapasiteten for uttak av gass er begrenset av hvor mye varme som kan absorberes fra omgivelsene, den flytende karbondioksiden må nemlig fordampe i flasken for å gjenoppbygge det trykk som tilsvarer gjeldende temperatur.
Sublimasjon av tørris frembringer en hvit tåke fra den kalde karbondioksid-luftblanding, samt kondensasjon av luftfuktigheten i omgivelsene. Dette gir visuelle effekter som blir brukt i teater og konserter. I dag er det vanlig med tåkekjøling som tilleggsutstyr for røykmaskiner, som drives med flytende karbondioksid.[75]
I økende grad blir karbondioksid anvendt i forbindelse med automatiserte prosesser for sandblåsing der overflater med spesielt høy renhet etterstrebes. Med sin kombinasjon av mekaniske, termiske og kjemiske egenskaper, kan «karbondioksid-snø», for eksempel oppløse og fjerne forskjellige typer av overflateurenheter uten gjenværende rester. [76]
Superkritisk karbondioksid er et løsemiddel som brukes til rengjøring og avfetting, for eksempel wafere i halvlederindustrien og tekstiler i renserier.[77] Karbondioksid i denne tilstanden benyttes også som et reaksjonsmedium for produksjon av finkjemikalier. Disse brukes for eksempel til fremstilling av smakstilsetninger, fordi isolerte enzymer ofte forblir aktive og ingen rester av oppløsningsmidler forblir i produktene, i motsetning til organiske oppløsningsmidler.
I tertiære oljeutvinning blir superkritisk karbondioksid brukt til fylling av oljereservoar for å rense oljen fra større dyp til overflaten.[78]
Bruk som kjemisk råstoff
I den kjemiske industri er karbondioksid brukt ved omsetning av ammoniakk, spesielt ved fremstilling av urea. I det første trinnet reagerer ammoniakk og karbondioksid til ammoniumkarbonat, som i det andre trinn reagerer videre under dannelse av urea og vann:[79]
Ved reduksjon med hydrogen blir formamide dannet. Vider vil reaksjon med aminer, så som Dimetylamin blir dimetylformamid dannet.[80]
Ved å la karbondioksid reagere med natriumfenolat oppnås gjennom Kolbe–Schmitt-reaksjonen salisylsyre.[81]
Ved reaksjon med etylen blir etylen fremstilt. Dette skjer ved den såkalte OMEGA-Prosessen meget selektivt med vann for å gi til glykol.
Ved reaksjon med karbondioksid med en Grignard-forbindelse fører til dannelse av karbonsyre, for eksempel:
Telomerisering av karbondioksid med to molekyler av 1,3-butadien under homogene Palladium-katalyse fører til dannelse av finkjemikalier som laktoner under milde reaksjonsbetingelser.[79]
Soda (natriumkarbonat) blir fremstilt i solvayprosessen av karbondioksid. Noen metallkarbonater slik som cerusitt, blir produsert for eksempel ved reaksjon mellom metallhydroksyder og karbondioksid. Slike stoffer blir brukt som fargestoff.
På et høyt oljepris og lav strømpris, kan det i fremtiden være lønnsomt med utvinning av metan via Sabatier-prosessen fra karbon fra karbondioksid og hydrogen ved elektrolyse, for eksempel via energiproduksjon fra vindkraftverker.[82] Ellers vil videre bruk av karbondioksid bli uøkonomisk av termodynamiske grunner.
Resirkulering av karbondioksid

I tillegg til karbonfangst og -lagring går forskningen også i retning av å konvertere karbondioksid som dannes under forbrenning av fossile brensler til nyttbare forbindelser, og om mulig, dannelse av energibærere på nytt. For eksempel kan reduksjonsforbindelser slik som metanol[83] og maursyre allerede fremstilles på denne måten.[84]
Tilsvarende er syntese av urea en mulighet. Et fransk forskerteam undersøkte organisk katalyse, ved konvertering til formamid eller dens derivater.[85][86] Sidens energi til å drive prosessen må tilføres, er ikke disse metodene egnet for økonomisk produksjon av energi. Forskere ved RWTH Aachen har utviklet en homogen katalytisk prosess for fremstilling av metanol fra karbondioksid og hydrogen under trykk med en spesiell ruthenium-fosfin-kompleks til stede i katalysatoren og reagenser i en løsning.[87] Likeledes er en kontinuerlig fremgangsmåte for fremstilling av maursyre utviklet med et organometallisk ruthenium-kompleks, karakterisert ved at karbondioksid innehar en dobbelrolle både som reaktant og i en superkritisk form i den ekstraherende fase der maursyren dannes.[88] I en annen variant som er utviklet av en spansk forskningsgruppe, kan karbondioksid omdannes via en iridium-katalysert hydrosilyleringsreaksjon og fanges opp i form av silyl-formater. Fra dette kan maursyre lett skilles ut. Denne reaksjon som allerede har blitt realisert på i mindre skala, foregår under meget milde reaksjonsbetingelser, er meget selektiv og har høy omsetning.[89]
I Niederaussem kraftverk utforske RWE og Brain AG hvordan mikroorganismer kan konvertere CO2.[90]
Andre bruksområder
Karbondioksid var opp til 1950-årene, vanlig i brukt som bedøvelse for mennesker, spesielt i USA,[91] og ble den gangen vurdert som svært tilfredsstillende. Etter dette er mer effektive anestetikum innført.
Imidlertid brukes fortsatt en metode med bedøving med karbondioksid før slakting av dyr.[92] Griser blir ført ned i grupper via en heis i en grop med en atmosfære som inneholder minst 80 % karbondioksid, hvor de mister bevisstheten. Denne prosedyren er kontroversielt og intensiv innsats gjøres for å forbedre metodene ut fra et dyrevernperspektiv.[93][94][95] Fisk blir lamslått ved å innføre gassformig karbondioksid eller ved å tilsette kullsyre i vannet.[96] Metoden med å bedøve slaktedyr med karbondioksid er underlagt ulike restriksjoner i forskjellige land, for eksempel bestemmelser for hvilke dyr som tillates bedøvd på denne måten.
Karbondioksid blir anvendt som avføringsmiddel i form av stikkpiller. Ved utvikling av natriumdihydrogenfosfat og natriumbikarbonat under oppløsning av stikkpillen blir karbondioksid frigjort og ekspanderer i tarmen, noe som i sin tur utløser avføringsrefleksen.[97]
Karbondioksid virker som et gjødsel, og brukes som det i drivhus. Grunnen til dette er mangelen på karbondioksid forårsaket av plantenes fotosyntese som forbruker CO2. Ved utilstrekkelig påfylling av frisk luft, spesielt om vinteren når ventilasjonen er lukket kan dette bli et problem. Karbondioksidet blir enten innført direkte som en ren gass eller som et forbrenningsprodukt av propan eller naturgass. Dette resulterer i en kobling av gjødsling og oppvarming. Den mulige økning av utbytte avhenger av omfanget av mangel på karbondioksid og i hvilken grad planter er utsatt for lys.[98] Karbondioksid blir anvendt i akvarier som et gjødsel for vannplanter. Ved tilførsel av organisk materiale øker karbondioksidinnholdet i vannet ved åndedrett på bekostning av oksygeninnholdet.[99]
CO2 anvendes for å fange blodsugende insekter og smittebærere. Disse bruker karbondioksid som forekommer i pusten til verten til å orientere seg etter. Det blir frigjort fra tørris, fra gassflasker eller fra forbrenning av propan eller butan. Dette lokker insekter i nærheten til å bli dratt inn i et eget innsug.[100]
Fysiologiske effekter og farer

Karbondioksid har skadevirkinger for dyr og mennesker om konsentrasjonen i innåndingsluften blir for stor. Den skadelige virkning er ikke bare basert på fortrengning av oksygenet i luften. EN-standarden EN 13779:2007 deler romluften inne i fire kvaliteter, avhengig av karbondioksidkonsentrasjonen: Verdier under 800 ppm regnes som god kvalitet, som moderat kvalitet regnes verdier mellom 800 og 1000 ppm (0,08 til 0,1 Vol %), mens verdier mellom 1000 og 1400 ppm anses som medium. For verdier over 1400 ppm er luftkvaliteten kategorisert som lav.[101] Til sammenligning er det globale gjennomsnittet av volumandel CO2 i luften cirka 400 ppm, men det varierer regionalt, og er sterkt avhengig av tid og sesongvariasjoner. Terskel grenseverdi for daglig eksponering i åtte timer per dag er 0,5 %.[102] Ved en konsentrasjon på 1,5 %, øker åndedrettens minuttvolum med mer enn 40 %.
Ved høy konsentrasjon av karbondioksid inntrer reduksjon, eller i verste fall opphør av de autonome reflekser som styrer åndedrettene, først inntreffer hyperventilering og til slutt apné.[103] Fra cirka 5 % karbondioksid i innåndingsluften oppstår hodepine og svimmelhet, ved høyere konsentrasjoner akselerert hjertefrekvens (takykardi), det oppstår økt blodtrykk, åndenød og forstyrrelser av bevisstheten, såkalt CO2-narkose. Konsentrasjon av karbondioksid på 8 % fører til døden i løpet av 30 til 60 minutter.[104][105]
På grunn av at høye karbondioksidkonsentrasjoner forekommer i kjellere, siloer, brønner og kloakkummer, oppstår det stadig ulykker når personer oppholder seg slike steder.[57] Gjennom gjæringsprosesser oppstår det betydelige mengder karbondioksid, ved gjæring av for eksempel én liter eplemost oppstår om lag 50 liter gjæringsgass. Ofte blir flere mennesker offer for en gjærgassforgifting fordi hjelperen under et redningsforsøk selv puster inn karbondioksid og bli bevisstløs. Redningen av et offer i situasjoner med høy karbondioksidkonsentrasjon er bare mulig for profesjonelt redningspersonell med uavhengig åndedrettsvern.[106]
Hvis tilstrekkelig ventilasjon ikke er tilstede, er naturlige konsentrasjoner av luften ofte formet av naturlig karbondioksidkilder i grotter og gruveganger. For eksempel har den italienske grotten Grotta del Cane (hundegrotten) en karbondioksidkonsentrasjon på cirka 70 %.[107]
Karbondioksidkonsentrasjonen i blodet påvirker dets pH-verdi og således har det en indirekte virkning på oksygenbalansen. Bikarbonat-buffersystemet, som er et karbonsyre-hydrogenkarbonat-buffer, utgjør omtrent 50 % av den totale bufferkapasiteten til blodet, som katalyseres av enzymet karbonsyreanhydrase.[108]
Ved lavere pH-verdien vil dets oksygenbindendekapasitet avta. Ved det samme oksygeninnholdet i luften transport hemoglobin mindre oksygen. De såkalte bohreffekten og haldaneeffekten beskriver disse situasjonene.[109] En høy konsentrasjon av karbondioksid er også skadelig for planter. Som en indikatorplante brukes som mais, etter seks dagers eksponering med et karbondioksidnivå på 10 000 ppm får striper på bladene.[110]
Økologiske betydningen

Planter og fotosyntetiske bakterier absorbere karbondioksid fra atmosfæren og omdanner den ved fotosyntese under påvirkning av lys og absorpsjon av vann, til i karbohydrater som glukose. Denne prosessen skjer frittgjør oksygen fra dekomposisjon av vann. De resulterende karbohydrater tjener som energikilder og byggemateriale for alle andre biokjemiske stoffer som polysakkarid, nukleinsyreer og proteiner. Karbondioksid gir dermed råstoff for dannelsen av all biomasse i primærproduksjon til økosystemene.[111]
Nedbrytning av biomasse etter celleånding er en reversering av prosessen med fotosyntese, med dannelse av karbondioksid og forbruk av oksygen.[112] Alle organismer i et økosystem ånder kontinuerlig, og er dermed avhengig av fotosyntesen som igjen er avhengig av tilgjengeligheten av lys. Dette fører til syklisk økning og reduksjon av karbondioksid i daglige og sesongmessige rytmer, avhengig av forskjellige lysintensitet.
I vann varierer også karbondioksidkonsentrasjonen i henhold til døgn- og årsrytmer. Karbondioksid og andre oppløste karbondsyrestoffer er i kjemisk likevekt, dette bestemmer det fremherskende pH-nivået i vannet i betydelig grad. Det kjemiske likevektsnivået av dissosiasjonen av ammonium/ammoniakk, nitritt/salpetersyrling, sulfid/hydrogensulfid er igjen avhengig av pH-nivået. Sammensetningen av disse stoffene avgjør giftigheten for organismene som lever i vann.[113]
Dersom karbondioksid er oppbrukt ved fotosyntese i vannet, noe som indikeres av en pH-verdi nær 8,3, er noen arter av alger og vannplanter i stand til å utvinne den ønskede karbondioksid fra oppløste hydrogenkarbonat, slik at hydroksydioner frigjøres og gjør pH-nivået mer alkalisk. I næringsrike vann som karpedammer kan pH-verdien stige til 12, med tilhørende helsemessige konsekvenser for fisken, for eksempel kjertelnekrose hos karpefisk.[114]
Forskere ved Senckenberg Biodiversität und Klima Forschungszentrum hadde i 2012 en felles studie med andre institusjoner, beregnet at sporeplanter, altså lag av lav, alger og mose ved siden av nitrogen, binder cirka 14 milliarder tonn karbondioksid årlig. De binder like mye karbondioksid som det slippes årlig ut av skogbranner og brenning av biomasse over hele verden. Det er imidlertid ikke mulig å bekjempe klimaendringer ved hjelp av lag av sporeplanter, siden denne to-dimensjonale vegetasjonen lagrer klimagassen karbondioksid bare for noen få år.[115][116]
En betydning lagring og frigjøring av karbondioksid skjer i jord. Hvor sterk frigjøringen av organisk bundet karbon fra jord er er påvirket av de respektive miljøforhold og andre faktorer. Dette er for tiden i stor grad ukjent. Frigjøringen er imidlertid akselerert ved oppvarming, noe som har vært påvist i nyere studier og som kan ha en effekt på klimaet.[117] Ved å indikere størrelsen av CO2-utslippene kan ulike prosesser bli sammenlignbare rent energimessig og økologisk. Disse vil bli konvertert til utslipp av karbondioksid fra fossile brensler.
Deteksjon og kvantifisering
En enkel påvisning av karbondioksid er oppnådd med en vandig kalsiumhydroksidoppløsning. For dette formål blir gassen som skal undersøkes innført i oppløsningen. Inneholder gassen karbondioksid, reagerer den med kalsiumhydroksid til vann og kalsium (kalk), som utfelles som et hvitt, fast stoff og oppløsningen blir uklar.
Med barytvann, en oppløsning i vann med bariumhydroksid blir testen mer sensitive, ettersom bariumkarbonat er mindre oppløselig enn kalsiumkarbonat.
I vandig oppløsning er karbondioksid titrering med 0,1 N Natronlut til pH-verdien 8,3, fargeforskyvningen av indikatoren fenolftalein. Målingen av syrebindende kapasitet, pH-nivå og elektriske ledningsevne, eller ionestyrken tillater beregning av karbondioksidinnholdet fra disse parameterne som følge av dissosiasjonlikevekt av karbonsyre.
Severinghaus-elektroden er en pH-elektrode med en bufferløsning av natrium, bestemmer karbondioksidkonsentrasjonen av en løsning ved å måle pH-forandring.[118]
Karbondioksid kan etter infrarød- eller Raman-spektroskopi, hvorved de asymmetriske strekkervibrasjonene samt vippevibrasjoner er infrarød-aktive, mens det symmetriske strekkevibrasjonen er Raman-aktivt ved et bølgetall på 1480 cm-1 Raman-aktiv.[119] Instrumentet som brukes til dette kalles NDIR-sensor (non-dispersive infrared sensor).
Referanser
- ^ Markus Reichstein: Universell und Überall. Der terrestrische Kohlenstoffkreislauf im Klimasystem. In: Jochem Marotzke, Martin Stratmann (Hrsg.): Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft. Beck, München 2015, ISBN 978-3-406-66968-2, S. 123-136, insb. S. 127.
- ^ Jochem Marotzke: "Vorhersagen sind schwierig..." Möglichkeiten und Grenzen von Klimamodellen, In: Ders., Martin Stratmann (Hrsg.): Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft. Beck, München 2015, ISBN 978-3-406-66968-2, S. 9-22, hier S. 22.
- ^ William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, ISBN 3-540-67033-5, S. 35.
- ^ William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, ISBN 3-540-67033-5, S. 50.
- ^ William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, ISBN 3-540-67033-5, S. 72.
- ^ J. Priestley, W. Hey: Observations on Different Kinds of Air. By Joseph Priestley, L L. D. F. R. S.. In: Philosophical Transactions of the Royal Society of London. 62, 1772, S. 147–264, doi:10.1098/rstl.1772.0021.
- ^ Humphry Davy: On the Applicatin of Liquids Formed by the Condensation of Gases as Mechanical Agents. In: Philosophical Transactions of the Royal Society of London, 113 (1823): S. 199–205, doi:10.1098/rstl.1823.0020.
- ^ Duane H. D. Roller, M. Thilorier: Thilorier and the First Solidification of a „Permanent“ Gas (1835). In: Isis. 43, 1952, S. 109, doi:10.1086/349402.
- ^ Markus Reichstein: Universell und Überall. Der terrestrische Kohlenstoffkreislauf im Klimasystem. In: Jochem Marotzke, Martin Stratmann (Hrsg.): Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft. Beck, München 2015, ISBN 978-3-406-66968-2, S. 123-136, insb. S. 125.
- ^ Martin Kappas: Klimatologie, Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-1827-2, S. 159
- ^ Andrea Rehmsmeier: Auf dünnem EisDeutschlandfunk – Wissenschaft im Brennpunkt vom 7. August 2016
- ^ ipa.arcticportal.org: International Permafrost Association (5. November 2016)
- ^ J. Ewald: Carbon Dioxide at NOAA’s Mauna Loa Observatory reaches new milestone: Tops 400 ppm. In: NOAA Research, 10. Mai 2013.
- ^ Pumphandle 2012: Time history of atmospheric carbon dioxide, Video der Geschichte des atmosphärischen Kohlenstoffs in den letzten 800.000 Jahren, carbontracker.noaa.gov
- ^ «400 Teile pro Million – CO2-Dichte in Atmosphäre so hoch wie nie». Rheinische Post. Besøkt 23. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ deutschlandfunk.de, Forschung aktuell, 5. November 2016, Volker Mrasek: Jeder New-York-Fluggast lässt drei Quadratmeter Arktis-Meereis schmelzen (5. November 2016)
- ^ «Innenraumluftqualität: Kohlendioxid (CO2), Temperatur und Luftfeuchte in Schulklassenräumen». Niedersächsisches Ministerium für Umwelt, Energie und Klimaschutz. Besøkt 19. mai 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ Karsten Schwanke, Nadja Podbregar, Dieter Lohmann, Harald Frater: Naturkatastrophen. Wirbelstürme, Beben, Vulkanausbrüche – entfesselte Gewalten und ihre Folgen, Springer Verlag, Berlin/Heidelberg 2009, ISBN 978-3-540-88684-6, S. 119.
- ^ «Carbon Dioxide through Geologic Time». Geoscience Research Division at Scripps Institution of Oceanography. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ Dieter Lüthi, Martine Le Floch, Bernhard Bereiter, Thomas Blunier, Jean-Marc Barnola, Urs Siegenthaler, Dominique Raynaud, Jean Jouzel, Hubertus Fischer, Kenji Kawamura, Thomas F. Stocker (2008). «High-resolution carbon dioxide concentration record 650,000–800,000 years before present». Nature. 453 (7193): 379. doi:10.1038/nature06949.
- ^ U. Siegenthaler (2005). «stable Carbon Cycle-Climate Relationship During the Late Pleistocene». Science. 310 (5752): 1313. doi:10.1126/science.1120130.
- ^ Iain Colin Prentice et al.: The Carbon Cycle and Atmospheric Carbon Dioxide. In: IPCC Third Assessment Report. 2001, S. 185, abgerufen am 21. Dezember 2013.
- ^ Buis, Alan; Ramsayer, Kate; Rasmussen, Carol (12 November 2015). «A Breathing Planet, Off Balance». NASA. Besøkt 13 November 2015. Sjekk datoverdier i
|besøksdato=, |dato=(hjelp) - ^ Staff (12 November 2015). «Audio (66:01) - NASA News Conference - Carbon & Climate Telecon». NASA. Besøkt 12 November 2015. Sjekk datoverdier i
|besøksdato=, |dato=(hjelp) - ^ St. Fleur, Nicholas (10 November 2015). «Atmospheric Greenhouse Gas Levels Hit Record, Report Says». New York Times. Besøkt 11 November 2015. Sjekk datoverdier i
|besøksdato=, |dato=(hjelp) - ^ Ritter, Karl (9 November 2015). «UK: In 1st, global temps average could be 1 degree C higher». Associated Press. Besøkt 11 November 2015. Sjekk datoverdier i
|besøksdato=, |dato=(hjelp) - ^ a b J. G. Canadell, C. Le Quere, M. R. Raupach, C. B. Field, E. T. Buitenhuis, P. Ciais, T. J. Conway, N. P. Gillett, R. A. Houghton, G. Marland: Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks. In: Proceedings of the National Academy of Sciences. 104, 2007, S. 18866–18870, doi:10.1073/pnas.0702737104.
- ^ «GRID-Arendal: Vital Climate Graphics: The present carbon cycle». Grid Arendal. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ A. P. Ballantyne, C. B. Alden, J. B. Miller, P. P. Tans, J. W. C. White: Increase in observed net carbon dioxide uptake by land and oceans during the past 50 years. In: Nature. 488, 2012, S. 70–72, doi:10.1038/nature11299.
- ^ S. A. Montzka, E. J. Dlugokencky, J. H. Butler: Non-CO2 greenhouse gases and climate change. In: Nature. 476, 2011, S. 43–50, doi:10.1038/nature10322.
- ^ Gerald A. Meehl, Warren M. Washington, Caspar M. Ammann, Julie M. Arblaster, T. M. L. Wigley, Claudia Tebaldi: Combinations of Natural and Anthropogenic Forcings in Twentieth-Century Climate. In: Journal of Climate. 17, 2004, S. 3721–3727, doi:<3721:CONAAF>2.0.CO;2 10.1175/1520-0442(2004)017<3721:CONAAF>2.0.CO;2.
- ^ James E. Hansen, Makiko Sato, Reto Ruedy, Larissa Nazarenko, Andrew Lacis, Gavin A. Schmidt, Gary Russell et al.: Efficacy of climate forcings. In: Journal of Geophysical Research. Vol. 110, Issue D18, 27. September 2005, doi:10.1029/2005JD005776.
- ^ «UN-Bericht: CO2-Konzentration in der Atmosphäre hat 2015 Rekordwert erreicht». Stern.de. Besøkt 22. januar 2017.
- ^ Zhenhao Duan, Rui Sun: An improved model calculating CO2 solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to 2000 bar. In: Chemical Geology. 193, 2003, S. 257–271, doi:10.1016/S0009-2541(02)00263-2.
- ^ Naomi M. Levine, Scott C. Doney. «How Long Can the Ocean Slow Global Warming?». Woods Hole Oceanographic Institution. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ Tom Garrison: Oceanography: an invitation to marine science, 2005, Verlag Thomson Brooks/Cole, Belmont, CA, ISBN 0-534-40887-7, S. 505.
- ^ J. B. Ries, A. L. Cohen, D. C. McCorkle: Marine calcifiers exhibit mixed responses to CO2-induced ocean acidification. In: Geology. 37, 2009, S. 1131–1134, doi:10.1130/G30210A.1.
- ^ «Killer-Seen Lautloser Tod aus der Tiefe». Der Spiegel. Besøkt 21. desember 2012. Ekstern lenke i
|utgiver=(hjelp) - ^ Michel Halbwachs, Klaus Tietze, Andreas Lorke, Clément Mudaheranwa. «Investigations in Lake Kivu after the Nyiragongo Eruption of January 2002» (PDF; 2,5 MB). Das Wasserforschungs-Institut des ETH-Bereichs. Besøkt 21. desember 2012.
- ^ «The Atmosphere of Venus». Department of Physics and Astronomy Georgie State University. Besøkt 22. mars 2010. Ekstern lenke i
|utgiver=(hjelp) - ^ «Kohlendioxid (fast) pur … Atmosphäre und Klima des Roten Planeten». Scinexx, das Wissensmagazin. Besøkt 22. mars 2010. Ekstern lenke i
|utgiver=(hjelp) - ^ E. Lellouch, B. Bezard, J.I. Moses, G.R. Davis, P. Drossart, H. Feuchtgruber, E.A. Bergin, R. Moreno, T. Encrenaz: The Origin of Water Vapor and Carbon Dioxide in Jupiter's Stratosphere. In: Icarus. 159, 2002, S. 112–131, doi:10.1006/icar.2002.6929.
- ^ Dale P. Cruikshank, Allan W. Meyer, Robert H. Brown, Roger N. Clark, Ralf Jaumann, Katrin Stephan, Charles A. Hibbitts, Scott A. Sandford, Rachel M.E. Mastrapa, Gianrico Filacchione, Cristina M. Dalle Ore, Philip D. Nicholson, Bonnie J. Buratti, Thomas B. McCord, Robert M. Nelson, J. Brad Dalton, Kevin H. Baines, Dennis L. Matson: Carbon dioxide on the satellites of Saturn: Results from the Cassini VIMS investigation and revisions to the VIMS wavelength scale. In: Icarus. 206, 2010, S. 561–572, doi:10.1016/j.icarus.2009.07.012.
- ^ «Hubble finds carbon dioxide on an extrasolar planet». Inoovations-Report, Forum für Wissenschaft, Industrie und Wirtschaft. Besøkt 22. mars 2010. Ekstern lenke i
|utgiver=(hjelp) - ^ L.B. d'Hendecourt, M. Jourdain de Muizon: The discovery of interstellar carbon dioxide. In: Astronomy and Astrophysics, 223 (1989), S. L5–L8 (Volltext).
- ^ Rebecca L. Rawls. Interstellar Chemistry. Parameteren
|Band=støttes ikke av malen. Mente du|volume=?) (hjelp); Parameteren|Nummer=støttes ikke av malen. Mente du|nummer=?) (hjelp); Parameteren|Online=støttes ikke av malen. Mente du|url=?) (hjelp); Parameteren|Sammelwerk=støttes ikke av malen. Mente du|work=?) (hjelp); Parameteren|Seiten=støttes ikke av malen. Mente du|pages=?) (hjelp); - ^ D. Talbi, E. Herbst: The gas-phase destruction of interstellar carbon dioxide: Calculations on the reactions between CO2 and H2 and between CO2 and H. In: Astronomy and Astrophysics. 386, 2002, S. 1139–1142, doi:10.1051/0004-6361:20020312.
- ^ Henrik Lund, Brian Vad Mathiesen, The role of Carbon Capture and Storage in a future sustainable energy system. In: Energy 44, (2012), 469-476, doi:10.1016/j.energy.2012.06.002.
- ^ o.A.: Schülerduden Chemie, Bibliografisches Institut & F.A. Brockhaus AG, Mannheim 2007, ISBN 978-3-411-05386-5, S. 195.
- ^ G. Hochgesand: Anwendung von Absorptionsverfahren für die CO2-Entfernung aus Natur- und Synthesegasen. In: Chemie Ingenieur Technik – CIT. 40, 1968, S. 432–440, doi:10.1002/cite.330400904.
- ^ Birgit Kessler, Jörg Von Eysmondt, Heinrich Merten: Nutzung von CO2 aus Rauchgasen für chemische Synthesen. In: Chemie Ingenieur Technik. 64, 1992, S. 1075–1083, doi:10.1002/cite.330641207.
- ^ H. Kolbe: Antiseptische Eigenschaften der Kohlensäure. In: Journal für Praktische Chemie. 26, 1882, S. 249–255, doi:10.1002/prac.18820260116.
- ^ a b «Carbon dioxide». dguv.de. Besøkt 22. januar 2017..
- ^ a b A. F. Holleman, E. Wiberg, N. Wiberg: (1995). Lehrbuch der Anorganischen Chemie. de Gruyter. s. 860. ISBN 3-11-012641-9.
- ^ A. Simon und K. Peters: Single-crystal refinement of the structure of carbon dioxide. In: Acta Crystallographica Section B. 1980, B36, S. 2750–2751, doi:10.1107/S0567740880009879.
- ^ Frank Wisotzky:Angewandte Grundwasserchemie, Hydrogeologie und hydrogeochemische Modellierung: Grundlagen, Anwendungen und Problemlösungen, 2011, Springer Verlag, ISBN 978-3-642-17812-2, S. 65.
- ^ a b Roland Benedix: Bauchemie. Vieweg+Teubner Verlag, ISBN 978-3-8348-0584-3, S. 113.
- ^ Hans-Dieter Barke: Chemiedidaktik heute. Springer-Verlag, Berlin 2001, ISBN 3-540-41725-7, S. 30.
- ^ «Informasjon om Karbondioksid». matvareguiden.no. Besøkt 19. januar 2017.
- ^ «Info-Broschüre – Backen mit Hefe». Besøkt 22. mars 2010. Parameteren
|werk=støttes ikke av malen. Mente du|work=?) (hjelp) - ^ Hugh Johnson, Steven Brook: Der große Johnson. Die Enzyklopädie der Weine, Weinbaugebiete und Weinerzeuger der Welt, Verlag Gräfe und Unzer GmbH, 2009, ISBN 3-8338-1621-X, S. 135.
- ^ a b A. Keith Thompson: Fruit and Vegetables Harvesting, Handling and Storage, Blackwell Publishing, Oxford 2003, ISBN 1-4051-0619-0, S. 61–70.
- ^ Hannah James und Jenny Jobling: The Flesh Browning Disorder of ‘Pink Lady’™ Apples. In: New York Fruit Quarterly, Band 16, Nr. 2, 2008, S. 23–28 Online PDF, 594 kB. Abgerufen am 22. Dezember 2013.
- ^ Irene Palacios et al.: Use of Modified Atmosphere Packaging to Preserve Mushroom Quality during Storage. In: Recent Patents on Food, Nutrition & Agriculture, Band 3, Heft 3, 2012, S. 196–203, doi:10.2174/2212798411103030196
- ^ Anne Emblem: Predicting packaging characteristics to improve shelf-life. In: David Kilcast und Persis Subramaniam (Hrsg.): The stability and shelf-life of food, 2000, Woodhead Publishing, Cambridge (UK), ISBN 1-85573-500-8, S. 145–169.
- ^ Joseph P. Kerry (Hrsg.): Advances in meat, poultry and seafood packaging, 2012, Woodhead Publishing, Cambridge (UK), ISBN 978-1-84569-751-8.
- ^ Saul Norman Katz. «Verfahren zum Entkoffeinieren von Kaffee mit einer superkritischen Flüssigkeit». Besøkt 21. desember 2013.
- ^ «Feuerwehr zu Gasunfall: "Keine Einsatz-Fehler"». Rheinische Post. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ «Carbon Dioxide as a Fire Suppressant: Examining the Risks». U.S. Environmental Protection Agency. Besøkt 22. mars 2010. Ekstern lenke i
|utgiver=(hjelp) - ^ «Kohlendioxid – Besonderheiten und Einsatzchancen als Kältemittel». Deutscher Klima- und Kältetechnischer Verein. Besøkt 22. mars 2010. Ekstern lenke i
|utgiver=(hjelp) - ^ «Natürliches Kältemittel für Pkw-Klimaanlagen». Umweltbundesamt. Besøkt 22. mars 2010. Ekstern lenke i
|utgiver=(hjelp) - ^ «Metall-Aktivgasschweißen (MAG/135)» (PDF; 42 kB). Deutscher Verband für Schweißen und verwandte Verfahren. Besøkt 22. mars 2010. Ekstern lenke i
|utgiver=(hjelp) - ^ Douglas A. Skoog, James J. Leary, S. Hoffstetter-Kuhn: Instrumentelle Analytik: Grundlagen – Geräte – Anwendungen. Springer-Verlag, ISBN 3-540-60450-2, S. 285.
- ^ «Druckgase zur Versorgung von Getränkeschankanlagen» (PDF). Berufsgenossenschaft Nahrungsmittel und Gastgewerbe. Besøkt 22. mars 2010. Ekstern lenke i
|utgiver=(hjelp) - ^ «Merkblatt – Verwendung von Nebelgeräten» (PDF). Besøkt 22. mars 2010.
- ^ Mark Krieg: Trockeneisstrahlen – mit Schnee oder mit Pellets? In: JOT Journal für Oberflächentechnik, 45.6 (2005): S. 50–55.
- ^ N. Dahmen, P. Griesheimer, A. Hebach: Reinigung und Oberflächenbehandlung mit komprimiertem Kohlendioxid. In: Galvanotechnik, 98 (2007) S. 1111–1120.
- ^ F. M. Orr, J. J. Taber: Use of Carbon Dioxide in Enhanced Oil Recovery. In: Science. 224, 1984, S. 563–569, doi:10.1126/science.224.4649.563.
- ^ a b Arno Behr. «Katalytische Kohlendioxid-Chemie». Aktuelle Wochenschau der GDCh. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ A. Behr, P. Ebbinghaus, F. Naendrup: Verfahrenskonzepte für die Übergangsmetallkatalysierten Synthesen von Ameisensäure und Dimethylformamid auf der Basis von Kohlendioxid. In: Chemie Ingenieur Technik. 75, 2003, S. 877–883, doi:10.1002/cite.200303221.
- ^ H. Kolbe: Ueber Synthese der Salicylsäure. In: Liebigs Ann., 113 (1860), S. 125–127, doi:10.1002/jlac.18601130120.
- ^ Alexis Bazzanella, Dennis Krämer, Martina Peters: CO2 als Rohstoff. In: Nachrichten aus der Chemie. 58, 2010, S. 1226–1230, doi:10.1002/nadc.201075752.
- ^ Rudolf-Werner Dreier (13. Juni 2012). Grünes Benzin aus Kohlenstoffdioxid. Informationsdienst Wissenschaft. Sjekk datoverdier i
|dato=(hjelp) - ^ Sebastian Matthes, Susanne Donner. «Der Klimakiller als Rohstoff». Wirtschaftswoche online. Besøkt 21. desember 2013.
- ^ Renate Hoer (8. November 2011). Kohlendioxid-Recycling?. Informationsdienst Wissenschaft. Sjekk datoverdier i
|dato=(hjelp) - ^ Christophe Das Neves Gomes, Olivier Jacquet, Claude Villiers, Pierre Thury, Michel Ephritikhine, Thibault Cantat: A Diagonal Approach to Chemical Recycling of Carbon Dioxide: Organocatalytic Transformation for the Reductive Functionalization of CO2. In: Angewandte Chemie. 124, 2012, S. 191–194, doi:10.1002/ange.201105516.
- ^ Sebastian Wesselbaum, Thorsten vom Stein, Jürgen Klankermayer, Walter Leitner: Hydrogenation of Carbon Dioxide to Methanol by Using a Homogeneous Ruthenium-Phosphine Catalyst. In: Angewandte Chemie. 124, 2012, S. 7617–7620, doi:10.1002/ange.201202320.
- ^ Sebastian Wesselbaum, Ulrich Hintermair, Walter Leitner: Continuous-Flow Hydrogenation of Carbon Dioxide to Pure Formic Acid using an Integrated scCO2 Process with Immobilized Catalyst and Base. In: Angewandte Chemie. 124, 2012, S. 8713–8716, doi:10.1002/ange.201203185.
- ^ Ralte Lalrempuia, Manuel Iglesias, Victor Polo, Pablo J. Sanz Miguel, Francisco J. Fernández-Alvarez, Jesús J. Pérez-Torrente, Luis A. Oro: Effective Fixation of CO2 by Iridium-Catalyzed Hydrosilylation. In: Angewandte Chemie. 124, 2012, S. 12996–12999, doi:10.1002/ange.201206165.
- ^ Stefan Pelzer: Maßgeschneiderte Mikroorganismen. In: Biologie in unserer Zeit. 42, 2012, S. 98–106, doi:10.1002/biuz.201210472.
- ^ A. A. LaVerne: Rapid coma technique of carbon dioxide inhalation therapy. In: Diseases of the nervous system, 14.5 (1953), S. 141.
- ^ B. Nowak, T.V. Mueffling, J. Hartung: Effect of different carbon dioxide concentrations and exposure times in stunning of slaughter pigs: Impact on animal welfare and meat quality. In: Meat Science. 75, 2007, S. 290–298, doi:10.1016/j.meatsci.2006.07.014.
- ^ Roswitha Nitzsche: Verbesserung des Tierschutzes bei der Schweineschlachtung durch Neugestaltung des Zutriebs zur und in die CO2-Betäubungsanlage, Abschlussbericht, BLE – Forschungsvorhaben 05UM012/W, o. J. (2008), Max Rubner – Institut, Institut für Sicherheit und Qualität bei Fleisch, Arbeitsbereich Technologie, Kulmbach Online PDF, 1,3 MB. Abgerufen am 22. Dezember 2013.
- ^ ohne Verfasser: Systemimmanente Probleme beim Schlachten. Stand 21. August 2012, Deutscher Tierschutzbund e. V., Bonn 2012 Online PDF, 78 kB. Abgerufen am 22. Dezember 2013.
- ^ Tierärztliche Vereinigung für Tierschutz (Hrsg.): Tierschutzgerechtes Schlachten von Rindern, Schweinen, Schafen und Ziegen. Merkblatt Nr. 89, 2007, Eigenverlag, Bramsche Online. Abgerufen am 22. Dezember 2013.
- ^ Lindsay G. Ross und Barbara Ross (Hrsg.): Anaesthetic and Sedative Techniques for Aquatic Animals. Third Edition, 2008, Blackwell Publishing, Oxford, ISBN 978-1-4051-4938-9, Kap. 9: Anaesthesia of Fish: II. Inhalation Anaesthesia Using Gases, S. 127–135.
- ^ T. Frieling: Diagnostik bei anorektalen Erkrankungen. In: Praxis 96.7 (2007): S. 243–247.
- ^ S. C. Wong: Elevated atmospheric partial pressure of CO2 and plant growth. In: Oecologia. 44, 1979, S. 68–74, doi:10.1007/BF00346400.
- ^ «Pflanzenpflege in Aquarien». Mongabay.com. Besøkt 22. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ Y. T. Qiu, J. Spitzen, R. S. Smallegange, B. G. J. Knols: Monitor systems for adult insect pests and disease vectors. In: W. Takken & B.G.J. Knols (Hrsg.) Ecology and control of vector-borne diseases, volume 1: Emerging pests and vector-borne diseases in Europe. Wageningen Academic Publishers, ISBN 978-90-8686-053-1, S. 329–353.
- ^ UBA, Bekanntmachung des Umweltbundesamtes: Gesundheitliche Bewertung von Kohlendioxid in der Innenraumluft. In: Bundesgesundheitsblatt-Gesundheitsforsch-Gesundheitsschutz 51 (2008), S. 1358–1369.
- ^ «Sicherheitsdatenblatt – Kohlendioxid (tiefkalt verflüssigt)» (PDF). Tyczka Kohlensäure. Besøkt 21. desember 2013. Parameteren
|archiv-url=støttes ikke av malen. Mente du|archive-url=?) (hjelp); Parameteren|archiv-arkivdato=støttes ikke av malen. (hjelp); Ekstern lenke i|utgiver=(hjelp) - ^ «Rauchvergiftungen/Vergiftungen durch Gase». Techniker Krankenkasse. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ «Erste Hilfe bei Kohlenstoffdioxid-Vergiftung». Deutsches Rotes Kreuz. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ «Carbon Dioxide – Life and Death» (PDF). Sensair. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ Bodo Gorgaß, Friedrich W. Ahnefeld, Rolando Rossi: Rettungsassistent und Rettungssanitäter, Springer Verlag, 1997, ISBN 3-540-21487-9, side. 305–314.
- ^ Ester Majo: I fenomeni vulcanici della grotta del Cane (Campi Flegrei) in rapporto alle variazioni atmosferiche. In: Bulletin Volcanologique. 4, 1927, S. 84–92, doi:10.1007/BF02719519.
- ^ David W. Christianson, Carol A. Fierke: Carbonic anhydrase: Evolution of the zinc binding site by nature and by design. In: Accounts of Chemical Research 29.7 (1996): S. 331–339, doi:10.1021/ar9501232.
- ^ Peter Karlson: Karlsons Biochemie und Pathobiochemie. Thieme-Verlag, Stuttgart 2005, ISBN 3-13-357815-4, side 38 (Auszug, s. 38, fra Google Books).
- ^ M. Schwarz: Carbon toxicity in plants. In: International Symposium on Growing Media and Hydroponics, 1997, S. 481 (Abstract).
- ^ Heinz-Gerhard Franck, Jürgen W. Stadelhofer: Sauerstoff und Kohlendioxid ? Schlüsselverbindungen des Lebens. In: Naturwissenschaften. 75, 1988, S. 585–590, doi:10.1007/BF00366470.
- ^ Wolfgang Thüne. «Kohlendioxid – Unverzichtbar für das Leben». Pharmazeutische Zeitung online. Besøkt 22. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ Christian Schwägerl. «Forscher fordern Säure-Limit für Ozeane». Der Spiegel. Besøkt 21. desember 2013. Ekstern lenke i
|utgiver=(hjelp) - ^ Kurt Bauer: Zur Bedeutung der Kohlensäure in Karpfenteichen. In: Österreichs Fischerei, 44/1991, S. 49–64.
- ^ W. Elbert, B. Weber, S. Burrows u. a. Contribution of cryptogamic covers to the global cycles of carbon and nitrogen. doi:10.1038/ngeo1486. Parameteren
|Band=støttes ikke av malen. Mente du|volume=?) (hjelp); Parameteren|Nummer=støttes ikke av malen. Mente du|nummer=?) (hjelp); Parameteren|Sammelutgiver=støttes ikke av malen. (hjelp); Parameteren|Seiten=støttes ikke av malen. Mente du|pages=?) (hjelp) - ^ Sabine Wendler (4. Juni 2012). Unscheinbar und doch gewaltig: Flechten, Algen und Moose sind Großspeicher für Stickstoff und CO2. Informationsdienst Wissenschaft. Sjekk datoverdier i
|dato=(hjelp) - ^ Eberhard Fritz (11. Juni 2012). Klimaerwärmung kann sich über Freisetzung von CO2 aus Waldböden selbst verstärken. Informationsdienst Wissenschaft. Sjekk datoverdier i
|dato=(hjelp) - ^ Adrianus Kleinleugenmors. «Vorrichtung zur Messung des Partialdrucks von Kohlendioxid». Europäisches Patent. Besøkt 21. desember 2013.
- ^ Arthur Adel, David Dennison: The Infrared Spectrum of Carbon Dioxide. Part I. In: Physical Review. 43, 1933, S. 716–723, doi:10.1103/PhysRev.43.716.
Litteratur
- Hans-Otto Pörtner: Auswirkungen von CO2-Eintrag und Temperaturerhöhung auf die marine Biosphäre. (PDF; 1,3 MB)
- Jens Soentgen, Armin Reller: CO2 – Lebenselixier und Klimakiller. Oekom-Verlag, München 2009, ISBN 978-3-86581-118-9.
- James Newton Butler: Carbon Dioxide Equilibria and Their Applications. Lewis Publishers, 1991, ISBN 0-87371-624-8.
- Martin M. Halmann, Meyer Steinberg: Greenhouse Gas Carbon Dioxide Mitigation: Science and Technology. CRC Press Inc, 1998, ISBN 1-56670-284-4.
- Martin M. Halmann: Chemical Fixation of Carbon Dioxide Methods Recycling: Methods of Recycling CO2 into Useful Products. CRC Press Inc, 1993, ISBN 0-8493-4428-X.
Eksterne lenker
(en) Carbon dioxide – galleri av bilder, video eller lyd på Commons
![]() Ordbokdefinisjonen av Karbondioksid i Wiktionary
Ordbokdefinisjonen av Karbondioksid i Wiktionary
- Carbon Dioxide Information Analysis Center U.S. Department of Energy
- Carbon Monitoring for Action (CARMA) – Database med informasjon om karbondioksidutslipp fra 50 000 kraftverk og 4000 energiselskaper over hele verden.
















