Alzheimers sykdom: Forskjell mellom sideversjoner
m robot legger til: kn:ಆಲ್ಝೈಮರ್ನ ಕಾಯಿಲೆ |
Translated from http://en.wikipedia.org/wiki/Alzheimer%27s_disease (revision: 391694519) using http://translate.google.com/toolkit with about 82% human translations. |
||
| Linje 1: | Linje 1: | ||
{{pp-semi|small=yes}}{{pp-move-indef}} |
|||
{{Infoboks sykdom |
|||
{{Redirect|Alzheimer}} |
|||
| Bilde = |
|||
{{infoboks sykdom |
|||
| Bildetekst = |
|||
| Navn = Alzheimers sykdom |
|||
| Image = COMPARISONSLICE HIGH.JPG |
|||
| Caption = Sammenligning av en normalt aldret hjerne (venstre) og en Alzheimer-pasients hjerne (høyre). Forskjellene er markert. |
|||
| ICD9 = {{ICD9|331.0}} |
|||
| DiseasesDB = 490 |
|||
| ICD10 = {{ICD10|G|30||g|30}}, {{ICD10|F|00||f|00}} |
|||
| ICD9 = {{ICD9|331.0}}, {{ICD9|290.1}} |
|||
| ICDO = |
|||
| OMIM = 104300 |
|||
| eMedicineTopic = |
|||
| MedlinePlus = 000760 |
|||
| eMedicineSubj = neuro |
|||
| eMedicineTopic = 13 |
|||
| MeshNavn = |
|||
| MeshID = D000544 |
|||
| GeneReviewsID = alzheimer |
|||
}} |
}} |
||
'''Alzheimers sykdom''' |
|||
også kalt '''senil demens av Alzheimers type, primær degenerativ demens av Alzheimers type (PDDAT),''' eller '''Alzheimers''' er den vanligste formen for [[Demens|demens]]. Denne uhelbredelige, degenerative og [[Terminal pasient|terminale sykdommen]] ble først beskrevet i 1906 av den tyske psykiateren og nevropatologen [[Alois Alzheimer|Alois Alzheimer]] og ble oppkalt etter ham. <ref name="pmid9661992"></ref> Oftest diagnostiseres den hos personer over 65 år. <ref>{{cite journal |
|||
|author=Brookmeyer R., Gray S., Kawas C. |
|||
|title=Projections of Alzheimer's disease in the United States and the public health impact of delaying disease onset |
|||
|journal=[[American Journal of Public Health]] |
|||
|volume=88 |
|||
|issue=9 |
|||
|pages=1337–42 |
|||
|year=1998 |
|||
|month=September |
|||
|pmid=9736873 |
|||
|pmc=1509089 |
|||
|doi=10.2105/AJPH.88.9.1337 |
|||
}}</ref> Den mindre utbredte tilstanden tidlig debut Alzheimers kan oppstå mye tidligere. I 2006 var det 26,6 millioner pasienter som led av denne sykdommen i hele verden. Alzheimers er spådd å ramme en av 85 mennesker globalt innen 2050. <ref name="Brookmeyer2007"></ref> |
|||
Selv om forløpet av Alzheimers sykdom er unikt for hver enkelt, er det mange felles symptomer. <ref name="alzheimers.org"> |
|||
'''Alzheimers sykdom''' (lat. ''Morbus Alzheimer'') er en [[nevrodegenerativ sykdom]] er den vanligste formen for [[demens]]. Sykdommen er oppkalt etter legen [[Alois Alzheimer]], som var den første som diagnostiserte sykdommen (1906). |
|||
{{cite web |
|||
| title=What is Alzheimer's disease? |
|||
| url=http://www.alzheimers.org.uk/site/scripts/documents_info.php?documentID=100 |
|||
| publisher=Alzheimers.org.uk |
|||
| year=2007 |
|||
| month=August |
|||
| accessdate=2008-02-21 |
|||
}}</ref> De tidligste observerbare symptomer er ofte feilaktig antatt å være "alders-relaterte" bekymringer eller manifestasjoner av stress. <ref name="pmid17222085">{{cite journal |
|||
|author=Waldemar G, Dubois B, Emre M, ''et al.'' |
|||
|title=Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline |
|||
|journal=Eur J Neurol |
|||
|volume=14 |
|||
|issue=1 |
|||
|pages=e1–26 |
|||
|year=2007 |
|||
|month=January |
|||
|pmid=17222085 |
|||
|doi=10.1111/j.1468-1331.2006.01605.x |
|||
}}</ref> I de tidlige stadiene er det vanligst observerte symptomet en manglende evne til å tilegne seg nye minner, slik som vanskeligheter med å gjenkalle nylig observerte fakta. Når Alzheimers mistenkes, blir diagnosen vanligvis bekreftet med atferdsmessige vurderinger og kognitive tester, ofte etterfulgt av en hjerneskanning hvis tilgjengelig. <ref name="alzres"> |
|||
{{cite web |
|||
| title=Alzheimer's diagnosis of AD |
|||
| url=http://www.alzheimers-research.org.uk/info/diagnosis/ |
|||
| publisher=Alzheimer's Research Trust |
|||
| accessdate=2008-02-29 |
|||
}}</ref> |
|||
Etter hvert som sykdommen forverres, omfatter symptomene forvirring, irritabilitet og aggresjon, humørsvingninger, nedbrytning av språkferdigheter, tap av langtidshukommelse, generell tilbaketrekning av den lidende ettersom sansene svekkes. <ref name="pmid17222085"></ref> <ref name="pmid17823840"> |
|||
Sykdommen angriper en del av hjernen som har avgjørende betydning for [[episodisk hukommelse]]. Selv om forlpøpet av sykdommen varierer mye for hvert individ som blir rammet, er det mange felles symptomer og diagnosen stilles som regel basert på kognitive tester som bør følges opp av hjernescanning. Det første stedet av hjernen som skades er [[entorhinal cortex]] som inneholder senteret for stedsansen (Hafting et al., 2005)[http://www.nature.com/nature/journal/v436/n7052/abs/nature03721.html], og blant de første symptomene på sykdommen er nettopp svekket stedsans. Deretter brer skadene seg til den nærliggende strukturen [[hippocampus]] som er avgjørende for å få lagret nye minner. Episodiske minner lagres midlertidig i hippocampus, men hippocampus er koblet opp mot nesten alle andre deler av hjernen og minnene overføres gradvis (konsolideres) til langtids lagring ulike steder i hjernebarken. Etterhvert som sykdommen utvikler seg er symptomer som stress, forvirring, irritasjon, humørsvingninger, språkproblemer og svekkede sanser og kroppsfunksjoner vil til slutt føre til døden. |
|||
{{cite journal |
|||
|author=Tabert MH, Liu X, Doty RL, Serby M, Zamora D, Pelton GH, Marder K, Albers MW, Stern Y, Devanand DP |
|||
|title=A 10-item smell identification scale related to risk for Alzheimer's disease |
|||
|journal=Ann. Neurol. |
|||
|volume=58 |
|||
|issue=1 |
|||
|pages=155–160 |
|||
|year=2005 |
|||
|pmid=15984022 |
|||
|doi=10.1002/ana.20533 |
|||
}}</ref> Gradvis går kroppsfunksjonene tapt, noe som til slutt fører til døden. <ref name="nihstages"> |
|||
{{cite web |
|||
| title=Understanding stages and symptoms of Alzheimer's disease |
|||
| url=http://www.nia.nih.gov/Alzheimers/Publications/stages.htm |
|||
| publisher=National Institute on Aging |
|||
| date=2007-10-26 |
|||
| accessdate=2008-02-21 |
|||
}}</ref> Individuell [[Prognose|prognose]] er vanskelig å vurdere, siden varigheten av sykdommen varierer. Alzheimers utvikler seg i en ubestemt periode før den blir helt åpenbar, og den kan forbli udiagnostisert i mange år. Den gjennomsnittlige levealderen etter diagnose er ca sju år. <ref name="pmid3776457">{{cite journal |
|||
|author=Mölsä PK, Marttila RJ, Rinne UK |
|||
|title=Survival and cause of death in Alzheimer's disease and multi-infarct dementia |
|||
|journal=Acta Neurol Scand |
|||
|volume=74 |
|||
|issue=2 |
|||
|pages=103–7 |
|||
|year=1986 |
|||
|month=August |
|||
|pmid=3776457 |
|||
|accessdate=2008-08-04 |
|||
|doi=10.1111/j.1600-0404.1986.tb04634.x |
|||
}}</ref> Færre enn tre prosent av pasientene lever mer enn 14 år etter diagnose. <ref name="pmid7793228">{{cite journal |
|||
|author=Mölsä PK, Marttila RJ, Rinne UK |
|||
|title=Long-term survival and predictors of mortality in Alzheimer's disease and multi-infarct dementia |
|||
|journal=ActaNeurol Scand |
|||
|volume=91 |
|||
|issue=3 |
|||
|pages=159–64 |
|||
|year=1995 |
|||
|month=March |
|||
|pmid=7793228 |
|||
}}</ref> |
|||
Årsaken til, og progresjonen av, Alzheimers sykdom er ikke godt forstått. Forskning viser at sykdommen er forbundet med plakk og fiberknuter i [[Hjerne|hjernen]]. <ref name="pmid15184601"></ref> Dagens behandlinger har liten symptomatisk nytte, ingen behandling for å utsette eller stanse utviklingen av sykdommen er foreløpig tilgjengelig. {{as of |
|||
Årsaken til sykdommen er uklare, men sykdommen fører til plakk-dannelse i hjernen og nerveceller i entorhinal cortex og hippocampus dør (Tiraboshi et al., 2004). Det er foreløpig ingen god medisin mot sykdommen, men både fysisk og mental trening kan virke preventivt[[3]]. |
|||
|2008}} Mer enn 500 kliniske studier har blitt gjennomført for å identifisere en mulig behandling for Alzheimers, men det er ukjent om noen av de testede intervensjonsstrategiene vil vise lovende resultater. <ref>{{cite web |
|||
|url=http://www.clinicaltrials.gov/ct2/results?term=alzheimer |
|||
|title= Alzheimer's Disease Clinical Trials |
|||
|accessdate= 2008-08-18 |
|||
|publisher= US National Institutes of Health |
|||
}}</ref> En rekke ikke-invasive, livsstilsvaner har blitt foreslått for å forebygge Alzheimers sykdom, men det er mangel på adekvat dokumentasjon for en sammenheng mellom disse anbefalingene og redusert degenerasjon. Mental stimulering, mosjon og et balansert kosthold er foreslått, både som en mulig forebygging og en fornuftig måte å håndtere sykdommen på. <ref name="prevention1"> |
|||
{{cite web |
|||
| title=Can Alzheimer's disease be prevented |
|||
| url=http://www.nia.nih.gov/NR/rdonlyres/63B5A29C-F943-4DB7-91B4-0296772973F3/0/CanADbePrevented.pdf |
|||
| format=pdf |
|||
| publisher=National Institute on Aging |
|||
| accessdate=2008-02-29 |
|||
| date =2006-08-29 |
|||
}}</ref> |
|||
Fordi Alzheimers ikke kan kureres og er degenerativ, er omsorg for pasientene viktig. Den viktigste omsorgspersonen er ofte ektefellen eller en nær slektning. <ref name="metlife.com">{{cite web |
|||
== Referanser == |
|||
| title= The MetLife study of Alzheimer's disease: The caregiving experience |
|||
| month= August | year= 2006 |archivedate=2008-06-25 |
|||
3. ^ "Can Alzheimer's disease be prevented" (pdf). National Institute on Aging. 2006-08-29. Retrieved 2008-02-29. |
|||
| archiveurl=http://web.archive.org/web/20080625071754/http://www.metlife.com/WPSAssets/14050063731156260663V1FAlzheimerCaregivingExperience.pdf |
|||
Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (June 2004). "The importance of neuritic plaques and tangles to the development and evolution of AD". Neurology 62 (11): 1984–9. |
|||
| publisher=MetLife Mature Market Institute |
|||
== Eksterne lenker == |
|||
| format=PDF |
|||
*[http://www.nasjonalforeningen.no Nasjonalforeningen for folkehelsen] |
|||
| accessdate=2008-02-12 |
|||
{{helsenotis}} |
|||
}}</ref> Alzheimers sykdom er kjent for å legge en stor belastning på omsorgspersoner, og presset kan være omfattende. Det kreves mye, både sosialt, psykologisk, fysisk og økonomisk av omsorgspersonen. <ref name="pmid17662119">{{cite journal |
|||
{{Medisinstubb}} |
|||
|author=Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J |
|||
[[Kategori:Psykiske lidelser og atferdsforstyrrelser]] |
|||
|title=Systematic review of information and support interventions for caregivers of people with dementia |
|||
[[Kategori:Sykdommer i nervesystemet]] |
|||
|journal=BMC Geriatr |
|||
[[Kategori:Nevropsykologi]] |
|||
|volume=7 |
|||
[[Kategori:Viktige artikler]] |
|||
|page=18 |
|||
|year=2007 |
|||
|pmid=17662119 |
|||
|pmc=1951962 |
|||
|doi=10.1186/1471-2318-7-18 |
|||
}}</ref> <ref name="pmid10489656">{{cite journal |
|||
|author=Schneider J, Murray J, Banerjee S, Mann A |
|||
|title=EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I—Factors associated with carer burden |
|||
|journal=International Journal of Geriatric Psychiatry |
|||
|volume=14 |
|||
|issue=8 |
|||
|pages=651–661 |
|||
|year=1999 |
|||
|month=August |
|||
|pmid=10489656 |
|||
|doi=10.1002/(SICI)1099-1166(199908)14:8<651::AID-GPS992>3.0.CO;2-B |
|||
|accessdate=2008-07-04 |
|||
}}</ref> <ref name="pmid10489657">{{cite journal |
|||
|author=Murray J, Schneider J, Banerjee S, Mann A |
|||
|title=EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II—A qualitative analysis of the experience of caregiving |
|||
|journal=International Journal of Geriatric Psychiatry |
|||
|volume=14 |
|||
|issue=8 |
|||
|pages=662–667 |
|||
|year=1999 |
|||
|month=August |
|||
|pmid=10489657 |
|||
|doi=10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4 |
|||
}}</ref> I [[Industriland|utviklede land]] er Alzheimers en av de mest kostbare sykdommene for samfunnet. <ref name="pmid15685097">{{cite journal |
|||
|author=Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP |
|||
|title=Impact économique de la démence (English: The economical impact of dementia) |
|||
|language=French |
|||
|journal=Presse Med |
|||
|issn=0755-4982 |
|||
|volume=34 |
|||
|issue=1 |
|||
|pages=35–41 |
|||
|year=2005 |
|||
|month=January |
|||
|pmid=15685097 |
|||
}}</ref> <ref name="pmid9543467">{{cite journal |
|||
|author=Meek PD, McKeithan K, Schumock GT |
|||
|title=Economic considerations in Alzheimer's disease |
|||
|journal=Pharmacotherapy |
|||
|volume=18 |
|||
|issue=2 Pt 2 |
|||
|pages=68–73; discussion 79–82 |
|||
|year=1998 |
|||
|pmid=9543467 |
|||
}}</ref> |
|||
==Kjennetegn== |
|||
{{Link UA|en}} |
|||
Sykdommens forløp er delt inn i fire trinn, med progressive mønstre for kognitiv svikt og funksjonssvikt. |
|||
{{Link UA|ro}} |
|||
===Pre-demens=== |
|||
De første symptomene er ofte forvekslet som relatert til alder eller stress. <ref name="pmid17222085"></ref> Detaljerte [[Nevropsykologi|nevropsykologiske]] tester kan avsløre milde kognitive vansker opp til åtte år før en person oppfyller kliniske kriterier for [[Diagnose|diagnostisering]] av Alzheimers. <ref name="pmid15324363">{{cite journal |
|||
|author=Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ |
|||
|title=Multiple cognitive deficits during the transition to Alzheimer's disease |
|||
|journal=J Intern Med |
|||
|volume=256 |
|||
|issue=3 |
|||
|pages=195–204 |
|||
|year=2004 |
|||
|month=Sep |
|||
|pmid=15324363 |
|||
|doi=10.1111/j.1365-2796.2004.01386.x |
|||
}}</ref> Disse tidlige symptomene kan påvirke de mest komplekse [[Dagliglivets aktiviteter|daglige gjøremål]]ene. <ref>{{cite journal |
|||
|author= Nygård L |
|||
|title=Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment? |
|||
|journal=Acta Neurol Scand |
|||
|volume=Suppl |
|||
|issue=179 |
|||
|pages=42–6 |
|||
|year=2003 |
|||
|month= |
|||
|pmid=12603250 |
|||
|doi= 10.1034/j.1600-0404.107.s179.8.x |
|||
}}</ref> Den mest merkbare svekkelsen er hukommelsestap, som viser seg som vansker med å huske nylig lærte fakta og manglende evne til å tilegne seg ny informasjon. <ref name="pmid15324363"></ref> <ref name="pmid12603249">{{cite journal |
|||
|author=Arnáiz E, Almkvist O |
|||
|title=Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease |
|||
|journal=Acta Neurol. Scand., Suppl. |
|||
|volume=179 |
|||
|pages=34–41 |
|||
|year=2003 |
|||
|pmid=12603249 |
|||
|doi=10.1034/j.1600-0404.107.s179.7.x |
|||
|accessdate=2008-06-12 |
|||
}}</ref> |
|||
Subtile problemer med eksekutivfunksjoner som krever [[Konsentrasjon (psykologi)|oppmerksomhet]], planlegging, fleksibilitet og [[Abstraksjon|abstrakt tenkning]], eller svekkelser i semantisk minne (minne av betydninger og begrepsrelasjoner), kan også være symptomer på tidlige stadier av Alzheimers. <ref name="pmid15324363"></ref> [[Apati|Apati]] kan observeres på dette stadiet, og er fortsatt det mest vedvarende nevropsykiatriske symptomet gjennom hele sykdomsforløpet. <ref>{{cite journal |
|||
|author=Landes AM, Sperry SD, Strauss ME, Geldmacher DS |
|||
|title=Apathy in Alzheimer's disease |
|||
|journal=J Am Geriatr Soc |
|||
|volume=49 |
|||
|issue=12 |
|||
|pages=1700–7 |
|||
|year=2001 |
|||
|month=Dec |
|||
|pmid=11844006 |
|||
|doi=10.1046/j.1532-5415.2001.49282.x |
|||
}}</ref> De prekliniske stadier av sykdommen har også blitt kalt mild kognitiv svekkelse <ref name="pmid12603249"></ref>, men om dette begrepet tilsvarer et annet diagnostisk trinn eller identifiserer det første trinnet i Alzheimers, er omstridt. <ref name="pmid17279076"> |
|||
{{cite journal |
|||
|author=Petersen RC |
|||
|title=The current status of mild cognitive impairment—what do we tell our patients? |
|||
|journal=Nat Clin Pract Neurol |
|||
|volume=3 |
|||
|issue=2 |
|||
|pages=60–1 |
|||
|year=2007 |
|||
|month=February |
|||
|pmid=17279076 |
|||
|doi=10.1038/ncpneuro0402 |
|||
}}</ref> |
|||
===Tidlig Alzheimers=== |
|||
Hos personer med Alzheimers fører den økende svekkelse av læring og hukommelse til slutt til en definitiv diagnose. Hos noen få av disse personene er vanskeligheter med språket, eksekutivfunksjoner, [[Persepsjon|persepsjon]] ([[Agnosi|agnosi]]) eller gjennomføring av bevegelser ([[Apraksi|apraksi]]) mer fremtredende enn problemer med hukommelsen. <ref name="pmid10653284"> |
|||
{{cite journal |
|||
|author=Förstl H, Kurz A |
|||
|title=Clinical features of Alzheimer's disease |
|||
|journal=European Archives of Psychiatry and Clinical Neuroscience |
|||
|volume=249 |
|||
|issue=6 |
|||
|pages=288–290 |
|||
|year=1999 |
|||
|pmid=10653284 |
|||
|doi=10.1007/s004060050101 |
|||
}}</ref> Alzheimers påvirker ikke all minnekapasitet likt. Eldre minner fra pasientens liv (episodisk minne), fakta lært (semantisk minne) og implisitt hukommelse (kroppens minne om hvordan man gjør ting, som å bruke en gaffel til å spise) påvirkes i mindre grad enn nye fakta eller minner. <ref name="pmid1300219"> |
|||
{{cite journal |
|||
|author=Carlesimo GA, Oscar-Berman M |
|||
|title=Memory deficits in Alzheimer's patients: a comprehensive review |
|||
|journal=Neuropsychol Rev |
|||
|volume=3 |
|||
|issue=2 |
|||
|pages=119–69 |
|||
|year=1992 |
|||
|month=June |
|||
|pmid=1300219 |
|||
|doi=10.1007/BF01108841 |
|||
}}</ref> <ref name="pmid8821346"> |
|||
{{cite journal |
|||
|author=Jelicic M, Bonebakker AE, Bonke B |
|||
|title=Implicit memory performance of patients with Alzheimer's disease: a brief review |
|||
|journal=International Psychogeriatrics |
|||
|volume=7 |
|||
|issue=3 |
|||
|pages=385–392 |
|||
|year=1995 |
|||
|pmid=8821346 |
|||
| doi = 10.1017/S1041610295002134 |
|||
}}</ref> |
|||
Språkproblemer er hovedsakelig preget av et krympende [[Ordforråd|ordforråd]] og redusert ordflyt, noe som fører til en generell utarming av muntlig og [[Skriftspråk|skriftlig språk]]. <ref name="pmid10653284"></ref> <ref name="pmid1856925">{{cite journal |
|||
|author=Taler V, Phillips NA |
|||
|title=Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review |
|||
|journal= J Clin Exp Neuropsychol |
|||
|volume=30 |
|||
|issue=5 |
|||
|pages=501–56 |
|||
|year=2008 |
|||
|month=Jul |
|||
|pmid=1856925 |
|||
|doi=10.1080/13803390701550128 |
|||
}}</ref> I denne fasen er personer med Alzheimers vanligvis i stand til å kommunisere grunnleggende ideer. <ref name="pmid10653284"></ref> <ref name="pmid1856925"></ref> <ref name="pmid7967534">{{cite journal |
|||
|author=Frank EM |
|||
|title=Effect of Alzheimer's disease on communication function |
|||
|journal=J S C Med Assoc |
|||
|volume=90 |
|||
|issue=9 |
|||
|pages=417–23 |
|||
|year=1994 |
|||
|month=September |
|||
|pmid=7967534 |
|||
}}</ref> Svekkelse i utføring av motoriske oppgaver som skriving, tegning eller påkledning, koordinering av visse bevegelser og vansker med planlegging kan være tilstede, men de er ofte ubemerket. <ref name="pmid10653284"></ref> Etter hvert som sykdommen utvikler seg, kan Alzheimers-pasienter ofte fortsette å utføre mange oppgaver selvstendig, men kan trenge hjelp eller tilsyn med de kognitivt mest krevende aktivitetene. <ref name="pmid10653284"></ref> |
|||
===Moderat Alzheimers=== |
|||
Progressiv forverring hindrer til slutt uavhengighet. Pasientene kan etter hvert ikke utføre de fleste vanlige daglige gjøremål. <ref name="pmid10653284"></ref> Talevansker blir tydelige på grunn av en manglende evne til å huske ord, noe som fører til hyppig feil bruk av ord (parafasi). Lese-og skriveferdigheter går også gradvis tapt. <ref name="pmid10653284"></ref> <ref name="pmid7967534"></ref> Komplekse motoriske sekvenser blir mindre koordinerte ettersom tiden går og Alzheimers utvikler seg, slik at risikoen for å falle øker. <ref name="pmid10653284"></ref> I løpet av denne fasen forverres hukommelsesproblemene, og det hender at pasienten ikke gjenkjenner nære slektninger. <ref name="pmid10653284"></ref> Langtidsminne, som tidligere var intakt, blir svekket. <ref name="pmid10653284"></ref> |
|||
Atferds-og nevropsykiatriske endringer blir mer uttalte. Vanlige manifestasjoner er vandring, irritabilitet og labil affekt som fører til gråt, utbrudd av spontan [[Aggresjon|aggresjon]] eller motstand mot omsorg. <ref name="pmid10653284"></ref> "Sundowning" kan også forekomme, dette er en tilstand hvor personen blir mer forvirret eller agitert sent på ettermiddagen eller tidlig på kvelden. <ref>{{cite journal |
|||
|author=Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A |
|||
|title=Sundowning and circadian rhythms in Alzheimer's disease |
|||
|journal=Am J Psychiatry |
|||
|volume=158 |
|||
|issue=5 |
|||
|pages=704–11 |
|||
|year=2001 |
|||
|month=May |
|||
|pmid=11329390 |
|||
|url=http://ajp.psychiatryonline.org/cgi/content/full/158/5/704 |
|||
|accessdate=2008-08-27 |
|||
|doi=10.1176/appi.ajp.158.5.704 |
|||
}}</ref> Omtrent 30 % av pasientene utvikler feilidentifisering og andre symptomer på [[Vrangforestilling|vrangforestilling]]er. <ref name="pmid10653284"></ref> Pasientene mister også innsikt i sykdomsprosessen sin og i sine egne begrensninger ([[Anosognosi|anosognosi]]). <ref name="pmid10653284"></ref> Inkontinens kan utvikles. <ref name="pmid10653284"></ref> Disse symptomene skaper stress for pårørende og omsorgspersoner. Dette kan reduseres ved å flytte pasienten fra [[Hjemmesykepleie|hjemmet]] til [[Sykehjem|institusjon]]. <ref name="pmid10653284"></ref> <ref name="pmid7806732">{{cite journal |
|||
|author=Gold DP, Reis MF, Markiewicz D, Andres D |
|||
|title=When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia |
|||
|journal=J Am Geriatr Soc |
|||
|volume=43 |
|||
|issue=1 |
|||
|pages=10–6 |
|||
|year=1995 |
|||
|month=January |
|||
|pmid=7806732 |
|||
}}</ref> |
|||
===Fremskreden Alzheimers=== |
|||
Under denne siste fasen av Alzheimers er pasienten helt avhengig av hjelp. <ref name="pmid10653284"></ref> Språket er redusert til enkle setninger eller enkelte ord, og til slutt forsvinner evnen til å snakke helt. <ref name="pmid10653284"></ref> <ref name="pmid7967534"></ref> Til tross for tapet av verbale språkferdigheter, kan pasienter ofte forstå og gjengjelde emosjonelle signaler. <ref name="pmid10653284"></ref> Selv om aggressivitet fortsatt kan være til stede, er ekstrem apati og utmattelse mye vanligere. <ref name="pmid10653284"></ref> |
|||
Pasientene vil til slutt ikke kunne utføre selv de enkleste oppgaver uten hjelp. <ref name="pmid10653284"></ref> Muskelmasse og mobilitet forringes til et punkt der de er sengeliggende, og de mister evnen til å spise selv. <ref name="pmid10653284"></ref> Alzheimers er en dødelig sykdom der dødsårsaken typisk vil være en ytre faktor som infeksjon av [[Trykksår|trykksår]] eller [[Lungebetennelse|lungebetennelse]], ikke selve sykdommen. <ref name="pmid10653284"></ref> |
|||
==Årsaker== |
|||
[[File:TAU HIGH.JPG|thumb|right|upright| Mikroskopbilde av en neurofibrillær fiberknute, konformt med hyperfosforylert tau-protein]] |
|||
Flere konkurrerende hypoteser prøver å forklare årsaken til sykdommen. Den eldste, som de fleste tilgjengelige medisinske behandlinger er basert på, er den ''kolinerge hypotesen'' <ref name="pmid10071091">{{cite journal |author=Francis PT, Palmer AM, Snape M, Wilcock GK |title=The cholinergic hypothesis of Alzheimer's disease: a review of progress |journal=J. Neurol. Neurosurg. Psychiatr. |volume=66 |issue=2 |pages=137–47 |year=1999 |month=February |pmid=10071091 |pmc=1736202 |doi= 10.1136/jnnp.66.2.137|url=}}</ref> som foreslår at Alzheimers skyldes redusert syntese av [[Nevrotransmitter|signalstoff]]et [[Acetylkolin|acetylkolin]]. Den kolinerge hypotesen har ikke lenger bred støtte, hovedsakelig fordi medisiner beregnet på å behandle acetylkolinmangelen ikke har vært veldig effektive. Andre kolinerge effekter har også blitt foreslått, for eksempel initiering av store ansamlinger av amyloid, <ref name="pmid15236795">{{cite journal |
|||
|author=Shen ZX |
|||
|title=Brain cholinesterases: II. The molecular and cellular basis of Alzheimer's disease |
|||
|journal=Med Hypotheses |
|||
|volume=63 |
|||
|issue=2 |
|||
|pages=308–21 |
|||
|year=2004 |
|||
|pmid=15236795 |
|||
|doi=10.1016/j.mehy.2004.02.031 |
|||
}}</ref> som fører til generalisert nevroinflammasjon. <ref name="pmid12934968">{{cite journal |
|||
|author=Wenk GL |
|||
|title=Neuropathologic changes in Alzheimer's disease |
|||
|journal=J Clin Psychiatry |
|||
|volume=64 Suppl 9 |
|||
|pages=7–10 |
|||
|year=2003 |
|||
|pmid=12934968 |
|||
}}</ref> |
|||
I 1991 postulerte ''amyloidhypotesen'' at amyloid beta (Aβ) avleiringer er den grunnleggende årsaken til sykdommen. <ref name="pmid1763432">{{cite journal |
|||
|author=Hardy J, Allsop D |
|||
|title=Amyloid deposition as the central event in the aetiology of Alzheimer's disease |
|||
|journal=Trends Pharmacol. Sci. |
|||
|volume=12 |
|||
|issue=10 |
|||
|pages=383–88 |
|||
|year=1991 |
|||
|month=October |
|||
|pmid=1763432 |
|||
|doi=10.1016/0165-6147(91)90609-V |
|||
}}</ref> <ref name="pmid11801334">{{cite journal |
|||
|author=Mudher A, Lovestone S |
|||
|title=Alzheimer's disease-do tauists and baptists finally shake hands? |
|||
|journal=Trends Neurosci. |
|||
|volume=25 |
|||
|issue=1 |
|||
|pages=22–26 |
|||
|year=2002 |
|||
|month=January |
|||
|pmid=11801334 |
|||
|doi=10.1016/S0166-2236(00)02031-2 |
|||
}}</ref> Støtte for dette postulatet kommer fra plasseringen av genet for amyloid beta forløperprotein (APP) på kromosom 21, sammen med det faktum at folk med trisomi 21 (Downs syndrom) som har en ekstra genkopi, nesten alltid får Alzheimers i 40-årsalderen. <ref name="pmid16904243">{{cite journal |
|||
|author=Nistor M, Don M, Parekh M, ''et al.'' |
|||
|title=Alpha- and beta-secretase activity as a function of age and beta-amyloid in Down syndrome and normal brain |
|||
|journal=Neurobiol Aging |
|||
|volume=28 |
|||
|issue=10 |
|||
|pages=1493–1506 |
|||
|year=2007 |
|||
|month=October |
|||
|pmid=16904243 |
|||
|doi=10.1016/j.neurobiolaging.2006.06.023 |
|||
|last12=Head |
|||
|first12=E |
|||
}}</ref> <ref name="pmid15639317">{{cite journal |
|||
|author=Lott IT, Head E |
|||
|title=Alzheimer disease and Down syndrome: factors in pathogenesis |
|||
|journal=Neurobiol Aging |
|||
|volume=26 |
|||
|issue=3 |
|||
|pages=383–89 |
|||
|year=2005 |
|||
|month=March |
|||
|pmid=15639317 |
|||
|doi=10.1016/j.neurobiolaging.2004.08.005 |
|||
}}</ref> Også APOE4, den viktigste genetiske risikofaktoren for Alzheimers, fører til stor ansamling av amyloid i hjernen før alzheimerssymptomer oppstår. Dermed skjer Aβ-deponering forut for klinisk Alzheimers. <ref name="pmid7566000">{{cite journal |
|||
|author=Polvikoski T, Sulkava R, Haltia M, ''et al.'' |
|||
|title=Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein |
|||
|journal=N Engl J Med |
|||
|volume=333 |
|||
|issue=19 |
|||
|pages=1242–47 |
|||
|year=1995 |
|||
|month=November |
|||
|pmid=7566000 |
|||
|doi=10.1056/NEJM199511093331902 |
|||
}}</ref> Ytterligere dokumentasjon kommer fra det faktum at [[Genetisk modifisert organisme|transgene]] mus som uttrykker en mutant form av det menneskelige APP-genet, utvikler fibrillært amyloidplakk og Alzheimerslignende hjernepatologi med spatielle læringsproblemer. <ref>Transgenic mice: |
|||
*{{cite journal |
|||
|author=Games D, Adams D, Alessandrini R, ''et al.'' |
|||
|title=Alzheimer-type neuropathology in transgenic mice overexpressing V717F beta-amyloid precursor protein |
|||
|journal=Nature |
|||
|volume=373 |
|||
|issue=6514 |
|||
|pages=523–27 |
|||
|year=1995 |
|||
|month=February |
|||
|pmid=7845465 |
|||
|doi=10.1038/373523a0 |
|||
}} |
|||
*{{cite journal |
|||
|author=Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D |
|||
|title=Comparison of neurodegenerative pathology in transgenic mice overexpressing V717F beta-amyloid precursor protein and Alzheimer's disease |
|||
|journal=J Neurosci |
|||
|volume=16 |
|||
|issue=18 |
|||
|pages=5795–811 |
|||
|year=1996 |
|||
|month=September |
|||
|pmid=8795633 |
|||
}} |
|||
*{{cite journal |
|||
|author=Hsiao K, Chapman P, Nilsen S, ''et al.'' |
|||
|title=Correlative memory deficits, Abeta elevation, and amyloid plaques in transgenic mice |
|||
|journal=Science (journal) |
|||
|volume=274 |
|||
|issue=5284 |
|||
|pages=99–102 |
|||
|year=1996 |
|||
|month=October |
|||
|pmid=8810256 |
|||
|doi=10.1126/science.274.5284.99 |
|||
}} |
|||
*{{cite journal |
|||
|author=Lalonde R, Dumont M, Staufenbiel M, Sturchler-Pierrat C, Strazielle C. |
|||
|title=Spatial learning, exploration, anxiety, and motor coordination in female APP23 transgenic mice with the Swedish mutation. |
|||
|journal=Brain Research (journal) |
|||
|volume=956 |
|||
|pages=36–44, year=2002 |
|||
|pmid=12426044 |
|||
|doi=10.1016/S0006-8993(02)03476-5 |
|||
|year=2002 |
|||
|issue=1 |
|||
}} </ ref> |
|||
En eksperimentell vaksine ble funnet å fjerne amyloid plakk i tidlige forsøk med mennesker, men det hadde ikke noen vesentlig effekt på demens. <ref name="pmid18640458">{{cite journal |
|||
|author=Holmes C, Boche D, Wilkinson D, ''et al.'' |
|||
|title=Long-term effects of Abeta42 immunisation in Alzheimer's disease: follow-up of a randomised, placebo-controlled phase I trial |
|||
|journal=Lancet |
|||
|volume=372 |
|||
|issue=9634 |
|||
|pages=216–23 |
|||
|year=2008 |
|||
|month=July |
|||
|pmid=18640458 |
|||
|doi=10.1016/S0140-6736(08)61075-2 |
|||
|last12=Nicoll |
|||
|first12=JA |
|||
}}</ref> Forskere har blitt ledet til å mistenke ikke-plakk Aβ-oligomerer (aggregater av mange monomerer) som primær sykdomsfremkallende form av Aβ. Disse giftige oligomerene, også kalt amyloid-avledede diffusible ligander (ADDLs), binder seg til en overflatereseptor på nerveceller og endrer strukturen av synapsen, og forstyrrer derved nervekommunikasjon. <ref name="pmid17251419"> |
|||
{{cite journal |
|||
|author=Lacor PN,''et al.'' |
|||
|title=Aß Oligomer-Induced Aberrations in Synapse Composition, Shape, and Density Provide a Molecular Basis for Loss of Connectivity in Alzheimer's Disease |
|||
|journal=Journal of Neuroscience |
|||
|volume=27 |
|||
|issue=4 |
|||
|pages=796–807 |
|||
|year=2007 |
|||
|month=January |
|||
|pmid=17251419 |
|||
|doi=10.1523/JNEUROSCI.3501-06.2007 |
|||
|last2=Buniel |
|||
|first2=MC |
|||
|last3=Furlow |
|||
|first3=PW |
|||
|last4=Clemente |
|||
|first4=AS |
|||
|last5=Velasco |
|||
|first5=PT |
|||
|last6=Wood |
|||
|first6=M |
|||
|last7=Viola |
|||
|first7=KL |
|||
|last8=Klein |
|||
|first8=WL |
|||
}}</ref> |
|||
En reseptor for Aβ-oligomerer kan være prionproteinet, det samme proteinet som har vært knyttet til kugalskap og den relaterte menneskelige tilstanden, Creutzfeldt-Jakobs sykdom. Den kan dermed potensielt knytte den underliggende mekanisme av disse nevrodegenerative lidelsene sammen med Alzheimers sykdom. <ref name="pmid19242475"> |
|||
{{cite journal |
|||
|author=Lauren J, Gimbel D, ''et al.'' |
|||
|title=Cellular prion protein mediates impairment of synaptic plasticity by amyloid-beta oligomers |
|||
|journal=Nature |
|||
|volume=457 |
|||
|issue=7233 |
|||
|pages=1128–32 |
|||
|year=2009 |
|||
|month=February |
|||
|pmid=19242475 |
|||
|doi=10.1038/nature07761 |
|||
|pmc=2748841 |
|||
}}</ref> |
|||
I 2009 ble denne teorien oppdatert, noe som tyder på at en nær slektning av beta-amyloid protein, og ikke nødvendigvis beta-amyloid i seg selv, kan være en årsak til sykdommen. Teorien hevder at en amyloid-relatert mekanisme som poder nevronkoblinger i hjernen i den raske vekstfasen tidlig i livet kan bli utløst av aldrings-relaterte prosesser senere i livet og føre til ødeleggelsen av nerveceller i Alzheimers sykdom. <ref name="Nikolaev">{{cite journal |
|||
| first= Anatoly | last= Nikolaev |
|||
| coauthors= Todd McLaughlin, Dennis O'Leary, [[Marc Tessier-Lavigne]] |
|||
| date= 19 February 2009 |
|||
| title= N-APP binds DR6 to cause axon pruning and neuron death via distinct caspases |
|||
| journal= Nature |
|||
| volume= 457 |
|||
| issue= 7232 |
|||
| pages= 981–989 |
|||
| issn= 0028-0836 |
|||
| pmid= 19225519 |
|||
| pmc= 2677572 |
|||
| doi= 10.1038/nature07767 |
|||
| accessdate= May 2009 }} |
|||
</ref> N-APP, et fragment av APP fra peptidets N-terminus, ligner beta-amyloid og spaltes fra APP av et av de samme enzymene. N-APP utløser selvdestrueringsveien ved å binde seg til en reseptor kalt nevronal dødsreseptor 6 (DR6, også kjent som TNFRSF21). <ref name="Nikolaev"></ref> DR6 er i høy grad uttrykt i de menneskelige hjerneregionene som er mest berørt av Alzheimers, så det er mulig at N-APP/DR6 veien kan bli kapret i den aldrende hjernen og forårsake skade. I denne modellen spiller beta-amyloid en komplementær rolle, ved å undertrykke synapsenes funksjon. |
|||
En studie fra 2004 fant at deponering av amyloid plakk ikke korrelerer godt med tap av nevroner. <ref name="pmid15039236">{{cite journal |
|||
|author=Schmitz C, Rutten BP, Pielen A, ''et al.'' |
|||
|title=Hippocampal neuron loss exceeds amyloid plaque load in a transgenic mouse model of Alzheimer's disease |
|||
|journal=Am J Pathol |
|||
|volume=164 |
|||
|issue=4 |
|||
|pages=1495–1502 |
|||
|year=2004 |
|||
|month=April |
|||
|pmid=15039236 |
|||
|pmc=1615337 |
|||
|last12=Steinbusch |
|||
|first12=HW |
|||
|last13=Pradier |
|||
|first13=L |
|||
|last14=Bayer |
|||
|first14=TA |
|||
}}</ref> Denne observasjonen støtter ''tau-hypotesen'' , ideen om at tau-protein-abnormiteter starter sykdomskaskaden. <ref name="pmid11801334"></ref> I denne modellen begynner hyperfosforylert tau å pare seg med andre tråder av tau. Etter hvert danner de nevrofibrillære fiberknuter inne i nervecellene. <ref name="pmid1669718">{{cite journal |
|||
|author=Goedert M, Spillantini MG, Crowther RA |
|||
|title=Tau proteins and neurofibrillary degeneration |
|||
|journal=Brain Pathol |
|||
|volume=1 |
|||
|issue=4 |
|||
|pages=279–86 |
|||
|year=1991 |
|||
|month=July |
|||
|pmid=1669718 |
|||
|doi=10.1111/j.1750-3639.1991.tb00671.x |
|||
}}</ref> Når dette skjer, disintegrerer mikrotubuli, og nervecellens transportsystem kollapser. <ref name="pmid15615638">{{cite journal |
|||
|author=Iqbal K, Alonso Adel C, Chen S, ''et al.'' |
|||
|title=Tau pathology in Alzheimer disease and other tauopathies |
|||
|journal=Biochim Biophys Acta |
|||
|volume=1739 |
|||
|issue=2–3 |
|||
|pages=198–210 |
|||
|year=2005 |
|||
|month=January |
|||
|pmid=15615638 |
|||
|doi=10.1016/j.bbadis.2004.09.008 |
|||
|url= |
|||
|last12=Grundke-Iqbal |
|||
|first12=I |
|||
}}</ref> Dette kan resultere først i feil i biokjemisk kommunikasjon mellom nevroner, og senere i celledød. <ref name="pmid17127334">{{cite journal |
|||
|author=Chun W, Johnson GV |
|||
|title=The role of tau phosphorylation and cleavage in neuronal cell death |
|||
|journal=Front Biosci |
|||
|volume=12 |
|||
|pages=733–56 |
|||
|year=2007 |
|||
|pmid=17127334 |
|||
|doi=10.2741/2097 |
|||
}}</ref> |
|||
Herpes simplex-virus type 1 har også blitt foreslått å spille en utløsende rolle hos mennesker som er bærere av de mottakelige versjonene av apoE-genet. <ref name="pmid18487848"> |
|||
{{cite journal |
|||
|author=Itzhaki RF, Wozniak MA |title=Herpes simplex virus type 1 in Alzheimer's disease: the enemy within |
|||
|journal=J Alzheimers Dis |
|||
|volume=13 |
|||
|issue=4 |
|||
|pages=393–405 |
|||
|year=2008 |
|||
|month=May |
|||
|pmid=18487848 |
|||
|doi= |
|||
|issn=1387-2877 |
|||
|url=http://iospress.metapress.com/openurl.asp?genre=article&issn=1387-2877&volume=13&issue=4&spage=393 |
|||
}}</ref> |
|||
En annen hypotese hevder at sykdommen kan være forårsaket av alders-relatert [[Myelin|myelin]]sammenbrudd i hjernen. Demyelinisering fører til forstyrrelser i aksonal transport, noe som fører til tap av nevroner som blir bedervet. Jern som utskilles i løpet av myelinsammenbrudd, er antatt å forårsake ytterligere skade. Homeostatiske myelinreparasjonsprosesser bidrar til utvikling av proteinavleiringer som amyloid-beta og tau. <ref>{{Cite pmid| 19775776}}</ref> <ref>{{Cite pmid| 15665415}}</ref> <ref>{{Cite pmid|18596894}}</ref> |
|||
Oksidativt stress er en vesentlig årsak i sykdomsdannelsen. <ref>{{cite pmid|19075578}}</ref> |
|||
Alzheimerspasienter viser 70 % tap av locus coeruleus-celler som avgir [[Noradrenalin|noradrenalin]] som (i tillegg til sin rolle som nevrotransmitter) lokalt diffunderer fra "åreknuter" som et endogent antiinflammatorisk middel i mikromiljøet rundt nervecellene, gliacellene, og blodkar i neocortex og hippocampus. <ref name="Heneka"> Heneka MT, Nadrigny F, Regen T, Martinez-Hernandez A, Dumitrescu-Ozimek L, Terwel D, Jardanhazi-Kurutz D, Walter J, Kirchhoff F, Hanisch UK, Kummer MP. (2010). [http://www.pnas.org.libproxy.ucl.ac.uk/content/107/13/6058.full.pdf Locus ceruleus controls Alzheimer's disease pathology by modulating microglial functions through norepinephrine.] Proc Natl Acad Sci USA A. 107:<span class="skype_pnh_print_container">6058-6063</span><span dir="ltr" class="skype_pnh_container"><span class="skype_pnh_mark"></span></span> {{doi|10.1073/pnas.0909586107}} PMID 20231476</ref> Det er vist at noradrenalin stimulerer mikroglia hos mus til å undertrykke Aβ-indusert produksjon av cytokiner og deres fagocytose av Aβ. <ref name="Heneka"></ref> Dette tyder på at degenerasjon av locus ceruleus kan være ansvarlig for økt Aβ- deponering i alzheimersrammede hjerner. <ref name="Heneka"></ref> |
|||
==Patofysiologi== |
|||
{{Main|Biochemistry of Alzheimer's disease}} |
|||
[[File:Alzheimer dementia (3) presenile onset.jpg|thumb|Histopatologisk bilde av senile plakk sett i cerebral cortex til en person med Alzheimers sykdom i presenil-stadiet. Sølvimpregnering.]] |
|||
===Nevropatologi=== |
|||
Alzheimers sykdom karakteriseres av tap av [[Nevron|nevroner]] og synapser i [[Hjernebarken|hjernebarken]] og enkelte subkortikale regioner. Dette tapet resulterer i [[Atrofi|atrofi]] av de berørte regionene, inkludert degenerasjon i [[Tinninglapp|tinninglappen]] og [[Isselapp|parietallapp]]en og deler av frontal cortex og cingulate gyrus <ref name="pmid12934968"></ref> Studier ved hjelp av [[Magnetresonanstomografi|MR]] og [[Positronemisjonstomografi|PET]] har dokumentert reduksjon av størrelsen på bestemte områder av hjernen hos pasienter samtidig som de utviklet seg fra mild kognitiv svekkelse til Alzheimers sykdom, og i sammenligning med tilsvarende bilder fra friske eldre voksne. <ref>{{cite journal |author=Moan R|title=MRI software accurately IDs preclinical Alzheimer's disease |journal=Diagnostic Imaging |date=July 20, 2009 |url=http://www.diagnosticimaging.com/news/display/article/113619/1428344}}</ref> |
|||
Både amyloid plakk og neurofibrillære fiberknuter er klart synlige ved mikroskopi av hjernen til dem som er rammet av Alzheimers. <ref name="pmid15184601">{{cite journal |
|||
|author=Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J |
|||
|title=The importance of neuritic plaques and tangles to the development and evolution of AD |
|||
|journal=Neurology |
|||
|volume=62 |
|||
|issue=11 |
|||
|pages=1984–9 |
|||
|year=2004 |
|||
|month=June |
|||
|pmid=15184601 |
|||
}}</ref> Plakk er tette, for det meste uløselige forekomster av amyloid-beta [[Peptid|peptid]] og [[Celle|celle]]materiale utenfor og rundt nervecellene. Fiberknuter (nevrofibrillære floker) er oppsamlinger av det microtubuli-assosierte proteinet tau som har blitt hyperfosforylisert og akkumulert inne i cellene selv. Mange eldre utvikler plakk og fiberknuter som følge av aldring, men hjernen til Alzheimers-pasienter har et større antall av dem i bestemte områder av hjernen som tinninglappen. <ref name="pmid8038565">{{cite journal |
|||
|author=Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH |
|||
|title=Regional distribution of neurofibrillary tangles and senile plaques in the cerebral cortex of elderly patients: a quantitative evaluation of a one-year autopsy population from a geriatric hospital |
|||
|journal=Cereb. Cortex |
|||
|volume=4 |
|||
|issue=2 |
|||
|pages=138–50 |
|||
|year=1994 |
|||
|pmid=8038565 |
|||
|doi=10.1093/cercor/4.2.138 |
|||
}}</ref> Lewy-legemer er ikke sjeldne i alzheimerspasientens hjerne. <ref name="pmid11816795">{{cite journal |
|||
|author=Kotzbauer PT, Trojanowsk JQ, Lee VM |
|||
|title=Lewy body pathology in Alzheimer's disease |
|||
|journal=J Mol Neurosci |
|||
|volume=17 |
|||
|issue=2 |
|||
|pages=225–32 |
|||
|year=2001 |
|||
|month=Oct |
|||
|pmid=11816795 |
|||
|doi=10.1385/JMN:17:2:225 |
|||
}}</ref> |
|||
===Biokjemi=== |
|||
[[File:Amyloid-plaque formation-big.jpg|right|thumb|border|Enzymer virker på APP (amyloid forløperprotein) og skjærer det i biter. Beta-amyloid fragment er viktig i dannelsen av senile plakk i Alzheimers.]] |
|||
Alzheimers sykdom har blitt identifisert som en protein sykdom (proteopati) relatert til feilaktige sammenføyninger av proteiner, forårsaket av opphopning av unormalt brettede A-beta og tau-proteiner i hjernen. <ref name="pmid14528050">{{cite journal |
|||
|author=Hashimoto M, Rockenstein E, Crews L, Masliah E |
|||
|title=Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer's and Parkinson's diseases |
|||
|journal=Neuromolecular Med. |
|||
|volume=4 |
|||
|issue=1–2 |
|||
|pages=21–36 |
|||
|year=2003 |
|||
|pmid=14528050 |
|||
|doi=10.1385/NMM:4:1-2:21 |
|||
}}</ref> Plakk består av små [[Peptid|peptid]]er, 39-43 [[Aminosyre|aminosyre]]r lang, kalt beta-amyloid (også skrevet som A-beta eller Aβ). Beta-amyloid er et fragment fra et større protein kalt amyloid forløperprotein (APP), et transmembran-protein som penetrerer gjennom nevronets membran. APP er kritisk viktig for nevronvekst og overlevelse og reparasjon etter skade. <ref name="pmid16822978">{{cite journal |
|||
|author=Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J |
|||
|title=Synapse formation and function is modulated by the amyloid precursor protein |
|||
|journal=J. Neurosci. |
|||
|volume=26 |
|||
|issue=27 |
|||
|pages=7212–21 |
|||
|year=2006 |
|||
|month=July |
|||
|pmid=16822978 |
|||
|doi=10.1523/JNEUROSCI.1450-06.2006 |
|||
}}</ref> <ref name="pmid12927332">{{cite journal |
|||
|author=Turner PR, O'Connor K, Tate WP, Abraham WC |
|||
|title=Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory |
|||
|journal=Prog. Neurobiol. |
|||
|volume=70 |
|||
|issue=1 |
|||
|pages=1–32 |
|||
|year=2003 |
|||
|month=May |
|||
|pmid=12927332 |
|||
|doi=10.1016/S0301-0082(03)00089-3 begin_of_the_skype_highlighting 0082(03)00089-3 end_of_the_skype_highlighting begin_of_the_skype_highlighting 0082(03)00089-3 end_of_the_skype_highlighting |
|||
}}</ref> Ved Alzheimers sykdom fører en ukjent prosess til at APP deles opp i mindre fragmenter av enzymer gjennom proteolyse. <ref name="pmid15787600">{{cite journal |
|||
|author=Hooper NM |
|||
|title=Roles of proteolysis and lipid rafts in the processing of the amyloid precursor protein and prion protein |
|||
|journal=Biochem. Soc. Trans. |
|||
|volume=33 |
|||
|issue=Pt 2 |
|||
|pages=335–8 |
|||
|year=2005 |
|||
|month=April |
|||
|pmid=15787600 |
|||
|doi=10.1042/BST0330335 |
|||
}}</ref> Ett av disse fragmentene gir opphav til fibriller av beta-amyloid, som danner klumper som avleires utenfor nevroner i tette formasjoner som kalles senilt plakk. <ref name="pmid15184601"></ref> <ref name="pmid15004691">{{cite journal |
|||
|author=Ohnishi S, Takano K |
|||
|title=Amyloid fibrils from the viewpoint of protein folding |
|||
|journal=Cell. Mol. Life Sci. |
|||
|volume=61 |
|||
|issue=5 |
|||
|pages=511–24 |
|||
|year=2004 |
|||
|month=March |
|||
|pmid=15004691 |
|||
|doi=10.1007/s00018-003-3264-8 |
|||
}}</ref> |
|||
[[File:TANGLES HIGH.jpg|right|thumb|I Alzheimers sykdom, fører endringer i tau protein til oppløsningen av mikrotubuli i hjernecellene.]] |
|||
Alzheimers er også ansett som en tauopati på grunn av unormal aggregering av tau-protein. Hver nervecelle har et [[Cytoskjellett|cytoskjelett]], en intern støttestruktur som delvis består av strukturer som kalles mikrotubuli. Disse mikrotubuli oppfører seg som skinner, og fører næringsstoffer og molekyler fra cellelegemet til endene av [[Akson|akson]]ene og tilbake. Et protein kalt ''Tau'' stabiliserer mikrotubuli når det er fosforylert, og kalles derfor et mikrotubulus-assosiert protein. Ved Alzheimers gjennomgår tau kjemiske endringer, blir hyperfosforylert, det begynner da å koble seg sammen med andre tråder, skaper neurofibrillære fiberknuter, og nevronets transportsystem går i oppløsning. <ref name="pmid17604998">{{cite journal |
|||
|author=Hernández F, Avila J |
|||
|title=Tauopathies |
|||
|journal=Cell. Mol. Life Sci. |
|||
|volume=64 |
|||
|issue=17 |
|||
|pages=2219–33 |
|||
|year=2007 |
|||
|month=September |
|||
|pmid=17604998 |
|||
|doi=10.1007/s00018-007-7220-x |
|||
}}</ref> |
|||
===Sykdomsmekanisme=== |
|||
Nøyaktig hvordan forstyrrelser av produksjon og aggregering av beta-amyloid-peptid gir opphav til Alzheimer-patologi er ikke kjent. <ref name="pmid17622778">{{cite journal |
|||
|author=Van Broeck B, Van Broeckhoven C, Kumar-Singh S |
|||
|title=Current insights into molecular mechanisms of Alzheimer disease and their implications for therapeutic approaches |
|||
|journal=Neurodegener Dis |
|||
|volume=4 |
|||
|issue=5 |
|||
|pages=349–65 |
|||
|year=2007 |
|||
|pmid=17622778 |
|||
|doi=10.1159/000105156 |
|||
}}</ref> Amyloid-hypotesen peker tradisjonelt på opphopning av beta-amyloid-[[Peptid|peptid]]er som den sentrale hendelsen som utløser degenerering av nevroner. Akkumulering av amyloid-fibriller, som antas å være den giftige formen for protein, er ansvarlig for å forstyrre cellens [[Kalsium|kalsium]]-[[Ioner|ion]]-[[Homeostase|homeostase]] og induserer programmert celledød ([[Apoptose|apoptose]]). <ref name="pmid2218531">{{cite journal |
|||
|author=Yankner BA, Duffy LK, Kirschner DA |
|||
|title=Neurotrophic and neurotoxic effects of amyloid beta protein: reversal by tachykinin neuropeptides |
|||
|journal=Science (journal) |
|||
|volume=250 |
|||
|issue=4978 |
|||
|pages=279–82 |
|||
|year=1990 |
|||
|month=October |
|||
|pmid=2218531 |
|||
|doi=10.1126/science.2218531 |
|||
}}</ref> Det er også kjent at Aβ selektivt bygger seg opp i [[Mitokondrium|mitokondriene]] i cellene i Alzheimers-pasienters hjerne, og det hemmer også visse [[Enzymer|enzym]]funksjoner og utnyttelse av [[Glukose|glukose]] hos nevronene. <ref name="pmid17424907">{{cite journal |
|||
|author=Chen X, Yan SD |
|||
|title=Mitochondrial Abeta: a potential cause of metabolic dysfunction in Alzheimer's disease |
|||
|journal=IUBMB Life |
|||
|volume=58 |
|||
|issue=12 |
|||
|pages=686–94 |
|||
|year=2006 |
|||
|month=December |
|||
|pmid=17424907 |
|||
|doi=10.1080/15216540601047767}}</ref> |
|||
Ulike inflammatoriske prosesser og cytokiner kan også ha en rolle i patologien bak Alzheimers sykdom. [[Betennelse|Betennelse]] er en generell markør for [[Vev (biologi)|vevsskader]] i alle sykdommer, og kan enten være sekundært til vevsskade i Alzheimers eller en markør for en immunologisk respons. <ref name="pmid15681814">{{cite journal |
|||
|author=Greig NH, Mattson MP, Perry T, ''et al.'' |
|||
|title=New therapeutic strategies and drug candidates for neurodegenerative diseases: p53 and TNF-alpha inhibitors, and GLP-1 receptor agonists |
|||
|journal=Ann. N. Y. Acad. Sci. |
|||
|volume=1035 |
|||
|pages=290–315 |
|||
|year=2004 |
|||
|month=December |
|||
|pmid=15681814 |
|||
|doi=10.1196/annals.1332.018 |
|||
}}</ref> |
|||
Endringer i fordelingen av ulike nevrotrope faktorer og i uttrykk for deres reseptorer som hjernederivert nevrotrop faktor (BDNF) har blitt beskrevet ved Alzheimers. <ref>{{cite journal |
|||
|author=Tapia-Arancibia L, Aliaga E, Silhol M, Arancibia S |
|||
|title=New insights into brain BDNF function in normal aging and Alzheimer disease |
|||
|journal=[[Brain Research Reviews]] |
|||
|volume=59 |
|||
|issue=1 |
|||
|pages=201–20 |
|||
|year=2008 |
|||
|month=Nov |
|||
|pmid=18708092 |
|||
|doi=10.1016/j.brainresrev.2008.07.007 |
|||
}}</ref> <ref>{{cite journal |
|||
|doi=10.1111/j.1601-183X.2007.00378.x |
|||
|author=Schindowski K, Belarbi K, Buée L |
|||
|title=Neurotrophic factors in Alzheimer's disease: role of axonal transport |
|||
|journal= [[Genes, Brain and Behavior]] |
|||
|volume=7 |
|||
|issue=Suppl 1 |
|||
|pages=43–56 |
|||
|year=2008 |
|||
|month=Feb |
|||
|pmid=18184369 |
|||
|pmc=2228393 |
|||
}}</ref> |
|||
===Genetikk=== |
|||
De aller fleste tilfeller av Alzheimers sykdom er sporadiske, noe som betyr at de ikke er genetisk arvet, selv om noen gener kan opptre som risikofaktorer. På den annen side, rundt 0,1 % av tilfellene er familiære former for autosomal-dominant arv, som vanligvis har en debut før fylte 65 år. <ref name="pmid16876668">{{cite journal |
|||
|author=Blennow K, de Leon MJ, Zetterberg H |
|||
|title=Alzheimer's disease |
|||
|journal=Lancet |
|||
|volume=368 |
|||
|issue=9533 |
|||
|pages=387–403 |
|||
|year=2006 |
|||
|month=July |
|||
|pmid=16876668 |
|||
|doi=10.1016/S0140-6736(06)69113-7 |
|||
|url= |
|||
}}</ref> |
|||
De fleste tilfeller av autosomal dominant familiær Alzheimrs kan tilskrives mutasjoner i ett av tre gener: amyloid forløperprotein (APP) og preseniliner 1 og 2. <ref name="pmid18332245">{{cite journal |
|||
|author=Waring SC, Rosenberg RN |
|||
|title=Genome-wide association studies in Alzheimer disease |
|||
|journal=Arch Neurol |
|||
|volume=65 |
|||
|issue=3 |
|||
|pages=329–34 |
|||
|year=2008 |
|||
|month=March |
|||
|pmid=18332245 |
|||
|doi=10.1001/archneur.65.3.329 |
|||
}}</ref> De fleste mutasjoner i APP og presenilin-gener øker produksjonen av et lite protein kalt Aβ 42, som er den viktigste komponenten i senile plakk. <ref name="pmid8938131">{{cite journal |
|||
|author=Selkoe DJ |
|||
|title=Translating cell biology into therapeutic advances in Alzheimer's disease |
|||
|journal=Nature |
|||
|volume=399 |
|||
|issue=6738 Suppl |
|||
|pages=A23–31 |
|||
|year=1999 |
|||
|month=June |
|||
|pmid=10392577 |
|||
|doi=10.1038/19866 |
|||
}}</ref> Noen av mutasjonene endrer bare størrelsesforholdet mellom Aβ42 og de andre viktige former, for eksempel Aβ40, uten å øke Aβ42-nivåer. <ref name="pmid8938131">{{cite journal |
|||
|author=Borchelt DR, Thinakaran G, Eckman CB, ''et al.'' |
|||
|title=Familial Alzheimer's disease-linked presenilin 1 variants elevate Aβ1-42/1-40 ratio in vitro and in vivo. |
|||
|journal=Neuron |
|||
|volume=17 |
|||
|issue=5 |
|||
|pages=1005–13 |
|||
|year=1996 |
|||
|month=Nov |
|||
|pmid=8938131 |
|||
|doi=10.1016/S0896-6273(00)80230-5 |
|||
|last12=Wang |
|||
|first12=R |
|||
|last13=Seeger |
|||
|first13=M |
|||
|last14=Levey |
|||
|first14=AI |
|||
|last15=Gandy |
|||
|first15=SE |
|||
|last16=Copeland |
|||
|first16=NG |
|||
|last17=Jenkins |
|||
|first17=NA |
|||
|last18=Price |
|||
|first18=DL |
|||
|last19=Younkin |
|||
|first19=SG |
|||
|last20=Sisodia |
|||
|first20=SS |
|||
}}</ref> <ref name="pmid17254019">{{cite journal |
|||
|author=Shioi J, Georgakopoulos A, Mehta P, ''et al.'' |
|||
|title=FAD mutants unable to increase neurotoxic Aβ 42 suggest that mutation effects on neurodegeneration may be independent of effects on Abeta. |
|||
|journal=J Neurochem. |
|||
|volume=101 |
|||
|issue=3 |
|||
|pages=674–81 |
|||
|year=2007 |
|||
|month=May |
|||
|pmid=17254019 |
|||
|doi=10.1111/j.1471-4159.2006.04391.x |
|||
}}</ref> Dette tyder på at presenilin-mutasjoner kan forårsake sykdom, selv om den lavere totale mengden Aβ produsert også kan peke på andre roller for presenilin eller en rolle for endringer i funksjonen av APP og / eller dets fragmenter enn Aβ. |
|||
De fleste tilfeller av Alzheimers sykdom viser ikke autosomal-dominant arv og kalles sporadisk Alzheimer. Genetiske forskjeller kan likevel fungere som risikofaktorer. Den mest kjente genetiske risikofaktor er arv av ε4-[[Allel|allelet]] av apolipoprotein E (APOE). <ref name="pmid8446617">{{cite journal |
|||
|author=Strittmatter WJ, Saunders AM, Schmechel D, ''et al.'' |
|||
|title=Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease |
|||
|journal=Proc. Natl. Acad. Sci. USA |
|||
|volume=90 |
|||
|issue=5 |
|||
|pages=1977–81 |
|||
|year=1993 |
|||
|month=March |
|||
|pmid=8446617 |
|||
|pmc=46003 |
|||
|doi=10.1073/pnas.90.5.1977 |
|||
}}</ref> <ref name="pmid16567625">{{cite journal |
|||
|author=Mahley RW, Weisgraber KH, Huang Y |
|||
|title=Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer's disease |
|||
|journal=Proc. Natl. Acad. Sci. U.S.A. |
|||
|volume=103 |
|||
|issue=15 |
|||
|pages=5644–51 |
|||
|year=2006 |
|||
|month=April |
|||
|pmid=16567625 |
|||
|pmc=1414631 |
|||
|doi=10.1073/pnas.0600549103 |
|||
|url= |
|||
}}</ref> Mellom 40 og 80 % av pasientene med Alzheimers har minst ett apoE4 allel. <ref name="pmid16567625"></ref> APOE4-allelet øker risikoen for sykdommen med tre ganger hos heterozygote (toeggede) tvillinger og med 15 ganger hos homozygote (eneggede) tvillinger. <ref name="pmid16876668"></ref> Genetikere er enige om at mange andre gener også fungerer som risikofaktorer eller har beskyttende effekter som påvirker utviklingen av sen debut Alzheimers sykdom. <ref name="pmid18332245"></ref> Over 400 gener har blitt testet for tilknytning til sent innsettende sporadisk Alzheimers, <ref name="pmid18332245"></ref>de fleste med null resultat. <ref name="pmid16876668"></ref> |
|||
==Diagnostikk== |
|||
[[File:PET Alzheimer.jpg|thumb|right|upright|PET-scan av hjernen til en person med Alzheimers som viser et tap av funksjon i tinninglappen]] |
|||
Alzheimers sykdom er vanligvis diagnostisert klinisk utfra pasientens historie, sammenholdt med slektningers historie og kliniske observasjoner, basert på tilstedeværelse av karakteristiske [[Nevrologi|nevrologiske]] og [[Nevropsykologi|nevropsykologiske]] funksjoner og fravær av andre mulige sykdommer. <ref name="pmid17407994">{{cite journal |
|||
|author=Mendez MF |
|||
|title=The accurate diagnosis of early-onset dementia |
|||
|journal=International Journal of Psychiatry Medicine |
|||
|volume=36 |
|||
|issue=4 |
|||
|pages=401–412 |
|||
|year=2006 |
|||
|pmid=17407994 |
|||
|doi=10.2190/Q6J4-R143-P630-KW41 |
|||
}}</ref> <ref name="pmid17018549">{{cite journal |
|||
|author=Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J |
|||
|title=Therapeutic approaches to Alzheimer's disease |
|||
|journal=Brain |
|||
|volume=129 |
|||
|issue=Pt 11 |
|||
|pages=2840–55 |
|||
|year=2006 |
|||
|month=November |
|||
|pmid=17018549 |
|||
|doi=10.1093/brain/awl280 |
|||
}}</ref> Avansert medisinsk bildediagnostikk med computertomografi (CT) eller [[Magnetresonanstomografi|magnetisk resonans-imaging]] (MRI), og med "[[SPECT|single photon emission computed tomografi]]" (SPECT) eller "[[Positronemisjonstomografi|positron-emisjons-tomografi]]" (PET) kan brukes til å ekskludere annen cerebral patologi eller undergrupper av demens. <ref> |
|||
{{cite web |
|||
|url = http://www.nice.org.uk/nicemedia/pdf/CG042quickrefguide.pdf |
|||
|format = PDF |
|||
|title = Dementia: Quick reference guide |
|||
|publisher = (UK) [[National Institute for Health and Clinical Excellence]] |
|||
|location = London |
|||
|month = November |
|||
|year = 2006 |
|||
|isbn = 1-84629-312-X |
|||
|accessdate = 2008-02-22 |
|||
}}</ref> Videre kan det forutsi overgang fra prodromalstadier (mild kognitiv svekkelse) til Alzheimers sykdom. <ref name="pmid16327345">{{cite journal |
|||
|author=Schroeter ML, Stein T, Maslowski N, Neumann J |
|||
|title=Neural correlates of Alzheimer's disease and mild cognitive impairment – A meta-analysis including 1351 patients. |
|||
|journal=NeuroImage |
|||
|volume=47 |
|||
|issue=4 |
|||
|pages=1196–1206 |
|||
|year=2009 |
|||
|pmid=19463961 |
|||
|pmc=2730171 |
|||
|doi=10.1016/j.neuroimage.2009.05.037 |
|||
}}</ref> |
|||
Vurdering av intellektuell fungering, inkludert minnetesting, kan videre karakterisere sykdommens stadium. <ref name="pmid17222085"></ref> Medisinske organisasjoner har skapt diagnostiske kriterier for å lette og standardisere den diagnostiske prosessen for praktiserende leger. Diagnosen kan bekreftes med svært høy nøyaktighet ved [[Obduksjon|obduksjon]] når hjernematerialet er tilgjengelig og kan bli undersøkt [[Histologi|histologisk]]. <ref name="pmid6610841">{{cite journal |
|||
|author=McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM |
|||
|title=Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease |
|||
|journal=Neurology |
|||
|volume=34 |
|||
|issue=7 |
|||
|pages=939–44 |
|||
|year=1984 |
|||
|month=July |
|||
|pmid=6610841 |
|||
}}</ref> |
|||
===Diagnostiske kriterier=== |
|||
De amerikanske organisasjonene The National Institute of Neurological and Communicative Disorders and Stroke (NINCDS) og Alzheimer's Disease and Related Disorders Association (ADRDA, nå kjent som Alzheimer's Association), etablerte den mest brukte NINCDS-ADRDA Alzheimers kriterier for diagnose i 1984, <ref name="pmid6610841"></ref> som ble grundig revidert i 2007. <ref name="pmid17616482">{{cite journal |
|||
|author=Dubois B, Feldman HH, Jacova C, ''et al.'' |
|||
|title=Research criteria for the diagnosis of Alzheimer's disease: revising the NINCDS-ADRDA criteria |
|||
|journal=Lancet Neurol |
|||
|volume=6 |
|||
|issue=8 |
|||
|pages=734–46 |
|||
|year=2007 |
|||
|month=August |
|||
|pmid=17616482 |
|||
|doi=10.1016/S1474-4422(07)70178-3 |
|||
|last12=O'brien |
|||
|first12=J |
|||
|last13=Pasquier |
|||
|first13=F |
|||
|last14=Robert |
|||
|first14=P |
|||
|last15=Rossor |
|||
|first15=M |
|||
|last16=Salloway |
|||
|first16=S |
|||
|last17=Stern |
|||
|first17=Y |
|||
|last18=Visser |
|||
|first18=PJ |
|||
|last19=Scheltens |
|||
|first19=P |
|||
}}</ref> Disse kriteriene krever tilstedeværelsen av kognitiv svekkelse og et mistenkt demenssyndrom, bekreftet ved nevropsykologisk testing for en klinisk diagnose av mulig eller sannsynlig Alzheimers. En histopatologisk bekreftelse inkludert en mikroskopisk undersøkelse av hjernevev er nødvendig for en definitiv diagnose. God [[Reliabilitet|statistisk reliabilitet]] og [[Validitet|validitet]] har blitt vist mellom de diagnostiske kriteriene og definitiv histopatologisk bekreftelse. <ref name="pmid7986174">{{cite journal |
|||
|author=Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF |
|||
|title=Reliability and validity of NINCDS-ADRDA criteria for Alzheimer's disease. The National Institute of Mental Health Genetics Initiative |
|||
|journal=Arch. Neurol. |
|||
|volume=51 |
|||
|issue=12 |
|||
|pages=1198–204 |
|||
|year=1994 |
|||
|month=December |
|||
|pmid=7986174 |
|||
}}</ref> Åtte kognitive domener er mest svekket i Alzheimers - [[Hukommelse|minne]], [[Språk|språk]], [[Persepsjon|perseptuelle ferdigheter]], [[Konsentrasjon (psykologi)|oppmerksomhet]], konstruktive evner, orientering, [[Problemløsning|problemløsning]] og funksjonsevne. Disse domenene er sammenfallende med NINCDS-ADRDA Alzheimers-kriterier som angitt i ''[[Diagnostic and Statistical Manual of Mental Disorders|Diagnostic and Statistical Manual of Mental Disorders]]'' (DSM-IV-TR) publisert av [[American Psychiatric Association|American Psychiatric Association]]. <ref>{{cite book |
|||
|last=American Psychiatric Association |
|||
|title=Diagnostic and statistical manual of mental disorders: DSM-IV-TR |
|||
|edition=4th Edition Text Revision |
|||
|publisher=American Psychiatric Association |
|||
|year=2000 |
|||
|location=Washington, DC |
|||
|isbn=0890420254 |
|||
}}</ref> <ref name="pmid8752526">{{cite journal |
|||
|author=Ito N |
|||
|title=[Clinical aspects of dementia] |
|||
|language=Japanese |
|||
|journal=Hokkaido Igaku Zasshi |
|||
|volume=71 |
|||
|issue=3 |
|||
|pages=315–20 |
|||
|year=1996 |
|||
|month=May |
|||
|pmid=8752526 |
|||
}}</ref> |
|||
===Diagnostiske verktøy=== |
|||
[[File:InterlockingPentagons.svg|right|thumb|Nevropsykologiske screeningtester kan hjelpe på diagnostisering av Alzheimers. I disse må pasientene kopiere tegninger lik den som vises på bildet, huske ord, lese og subtrahere tall.]] |
|||
Nevropsykologiske tester som [[Mini Mental Status|Mini Mental Status]] (MMS) er mye brukt for å evaluere kognitiv svikt. Mer omfattende testing er nødvendig for å få resultater med høy pålitelighet, særlig i de tidligste stadier av sykdommen. <ref name="pmid1512391">{{cite journal |
|||
|author=Tombaugh TN, McIntyre NJ |
|||
|title=The mini-mental state examination: a comprehensive review |
|||
|journal=J Am Geriatr Soc |
|||
|volume=40 |
|||
|issue=9 |
|||
|pages=922–35 |
|||
|year=1992 |
|||
|month=September |
|||
|pmid=1512391 |
|||
}}</ref> <ref name="pmid9987708">{{cite journal |
|||
|author=Pasquier F |
|||
|title=Early diagnosis of dementia: neuropsychology |
|||
|journal=J. Neurol. |
|||
|volume=246 |
|||
|issue=1 |
|||
|pages=6–15 |
|||
|year=1999 |
|||
|month=January |
|||
|pmid=9987708 |
|||
|doi=10.1007/s004150050299 |
|||
}}</ref> Nevrologisk undersøkelse tidlig i Alzheimers vil vanligvis gi normale resultater, med unntak av åpenbar kognitiv svikt, som kanskje ikke avviker fra det som følger av andre sykdomsprosesser, inkludert andre årsaker til demens. |
|||
Videre nevrologiske undersøkelser er avgjørende for [[Differensialdiagnose|differensialdiagnose]] av Alzheimers og andre sykdommer. <ref name="pmid17222085"></ref> Intervjuer med familiemedlemmer er også benyttet i vurderingen av sykdommen. Omsorgspersoner kan gi viktig informasjon om evne til å gjennomføre daglige gjøremål, så vel som reduksjonen av personens mentale fungering over tid. <ref name="pmid16327345">{{cite journal |
|||
|author=Harvey PD, Moriarty PJ, Kleinman L, ''et al.'' |
|||
|title=The validation of a caregiver assessment of dementia: the Dementia Severity Scale |
|||
|journal=Alzheimer Dis Assoc Disord |
|||
|volume=19 |
|||
|issue=4 |
|||
|pages=186–94 |
|||
|year=2005 |
|||
|pmid=16327345 |
|||
|doi=10.1097/01.wad.0000189034.43203.60 |
|||
}}</ref> En omsorgspersons synspunkt er spesielt viktig, siden en person med Alzheimers ofte ikke er klar over sin egen [[Anosognosi|svekkelse]]. <ref name="pmid15738860">{{cite journal |
|||
|author=Antoine C, Antoine P, Guermonprez P, Frigard B |
|||
|title=[Awareness of deficits and anosognosia in Alzheimer's disease.] |
|||
|language=French |
|||
|journal=Encephale |
|||
|volume=30 |
|||
|issue=6 |
|||
|pages=570–7 |
|||
|year=2004 |
|||
|pmid=15738860 |
|||
|doi=10.1016/S0013-7006(04)95472-3 |
|||
}}</ref> Mange ganger har også familiene vanskeligheter med å oppdage de første demenssymptomene og kan ikke kommunisere nøyaktig informasjon til legen. <ref name="pmid16197855">{{cite journal |
|||
|author=Cruz VT, Pais J, Teixeira A, Nunes B |
|||
|title=[The initial symptoms of Alzheimer disease: caregiver perception] |
|||
|language=Portuguese |
|||
|journal=Acta Med Port |
|||
|volume=17 |
|||
|issue=6 |
|||
|pages=435–44 |
|||
|year=2004 |
|||
|pmid=16197855 |
|||
}}</ref> |
|||
En annen, nyere og objektiv markør for sykdommen, er analysen av [[Cerebrospinalvæske|spinalvæske]] for amyloid beta- eller tau-proteiner. <ref name="pmid17612711">{{cite journal |
|||
|author=Marksteiner J, Hinterhuber H, Humpel C |
|||
|title=Cerebrospinal fluid biomarkers for diagnosis of Alzheimer's disease: beta-amyloid(1-42), tau, phospho-tau-181 and total protein |
|||
|journal=Drugs Today |
|||
|volume=43 |
|||
|issue=6 |
|||
|pages=423–31 |
|||
|year=2007 |
|||
|month=June |
|||
|pmid=17612711 |
|||
|doi=10.1358/dot.2007.43.6.1067341 |
|||
}}</ref>Den omfatter både total tau-protein og fosforylert tau-<sub>181P</sub>-protein-konsentrasjoner. <ref name="demeyer"></ref> Når man søker etter disse proteinene ved hjelp av en [[Spinalpunksjon|spinalpunksjon]] kan man forutsi utbruddet av Alzheimers med en [[Sensitivitet|sensitivitet]] på mellom 94 % og 100 %. <ref name="demeyer"></ref> Ved å bruke dette sammen med eksisterende bildediagnostiske teknikker, kan leger identifisere pasienter med signifikant hukommelsestap som allerede er i ferd med å utvikle sykdommen. <ref name="demeyer">{{cite journal |
|||
|author=De Meyer G, Shapiro F, Vanderstichele H, Vanmechelen E, Engelborghs S, De Deyn PP, Coart E, Hansson O, Minthon L, Zetterberg H, Blennow K, Shaw L, Trojanowski JQ |
|||
|title=Diagnosis-Independent Alzheimer Disease Biomarker Signature in Cognitively Normal Elderly People |
|||
|journal=Arch Neurol. |
|||
|volume=67 |
|||
|issue=8 |
|||
|pages=949–56 |
|||
|year=2010 |
|||
|month=August |
|||
|pmid=20697045 |
|||
|doi=10.1001/archneurol.2010.179 |
|||
}}</ref> Spinalvæske-testene er kommersielt tilgjengelige, i motsetning til den nyeste bildediagnostiske teknologien. <ref>{{cite news |
|||
|author=Kolata G |
|||
|title=Spinal-Fluid Test Is Found to Predict Alzheimer's |
|||
|url=http://www.nytimes.com/2010/08/10/health/research/10spinal.html |
|||
|work=[[The New York Times]] |
|||
|date=August 9, 2010 |
|||
|accessdate=August 10, 2010 |
|||
}}</ref> Alzheimers ble diagnostisert hos en tredjedel av folk som ikke har noen symptomer i en studie i 2010, noe som betyr at sykdommen oppstår lenge før symptomene oppstår. <ref>{{cite news |
|||
|author=Roan S |
|||
|title=Tapping into an accurate diagnosis of Alzheimer's disease |
|||
|url=http://www.latimes.com/health/boostershots/aging/la-heb-alzheimers-20100809,0,5683387.story |
|||
|work=[[Los Angeles Times]] |
|||
|date=August 9, 2010 |
|||
|accessdate=August 10, 2010 |
|||
}}</ref> |
|||
Supplerende testing gir ekstra informasjon om noen av sidene ved sykdommen eller brukes for å utelukke andre diagnoser. Blodprøver kan identifisere andre årsaker til demens enn Alzheimers <ref name="pmid17222085"></ref>, årsaker som i sjeldne tilfeller kan være reversible. <ref>{{cite journal |
|||
|author=Clarfield AM |
|||
|title=The decreasing prevalence of reversible dementias: an updated meta-analysis |
|||
|journal=Arch. Intern. Med. |
|||
|volume=163 |
|||
|issue=18 |
|||
|pages=2219–29 |
|||
|year=2003 |
|||
|month=October |
|||
|pmid=14557220 |
|||
|doi=10.1001/archinte.163.18.2219 |
|||
}}</ref> Det er vanlig å utføre tester på skjoldbruskkjertelfunksjon, vurdere vitamin B12, utelukke syfilis, utelukke metabolske problemer (inkludert tester for nyrefunksjonen, elektrolyttnivåer og for diabetes), vurdere nivåer av tungmetaller (f.eks. bly, kvikksølv) og anemi. (Se differensialdiagnose for aldersdemens). Det er også nødvendig å utelukke [[Delirium|delir]]. |
|||
[[Test (psykologi)|Psykologiske tester]] for depresjon brukes, fordi depresjon kan enten være sammenfallende med Alzheimer (se depresjon ved Alzheimers sykdom), et tidlig tegn på kognitiv svikt <ref>{{cite journal |author=Sun x, Steffens DC, Au R, ''et al.'' |title=Amyloid-Associated Depression: A Prodromal Depression of Alzheimer Disease? |journal=Arch Gen Psychiatry |volume=65 |issue=5 |pages=542–550|year=2008 |url=http://archpsyc.ama-assn.org/cgi/content/short/65/5/542 |doi=10.1001/archpsyc.65.5.542 |pmid=18458206 |last1=Sun |first1=X |last2=Steffens |first2=DC |last3=Au |first3=R |last4=Folstein |first4=M |last5=Summergrad |first5=P |last6=Yee |first6=J |last7=Rosenberg |first7=I |last8=Mwamburi |first8=DM |last9=Qiu |first9=WQ}}</ref>, eller til og med årsaken. <ref name="pmid9153154">{{cite journal |
|||
|author=Geldmacher DS, Whitehouse PJ |
|||
|title=Differential diagnosis of Alzheimer's disease |
|||
|journal=Neurology |
|||
|volume=48 |
|||
|issue=5 Suppl 6 |
|||
|pages=S2–9 |
|||
|year=1997 |
|||
|month=May |
|||
|pmid=9153154 |
|||
}}</ref> <ref name="pmid17495754">{{cite journal |
|||
|author=Potter GG, Steffens DC |
|||
|title=Contribution of depression to cognitive impairment and dementia in older adults |
|||
|journal=Neurologist |
|||
|volume=13 |
|||
|issue=3 |
|||
|pages=105–17 |
|||
|year=2007 |
|||
|month=May |
|||
|pmid=17495754 |
|||
|doi=10.1097/01.nrl.0000252947.15389.a9 |
|||
}}</ref> |
|||
====Bildediagnostikk==== |
|||
Når de er tilgjengelige som diagnostiske verktøy, brukes [[SPECT|single photon emission computed tomography]] (SPECT) og [[Positronemisjonstomografi|positronemisjonstomografi]] (PET) til å bekrefte en Alzheimers-diagnose i forbindelse med mental status-undersøkelse. <ref name="pmid16785801">{{cite journal |
|||
|author=Bonte FJ, Harris TS, Hynan LS, Bigio EH, White CL |
|||
|title=Tc-99m HMPAO SPECT in the differential diagnosis of the dementias with histopathologic confirmation |
|||
|journal=Clin Nucl Med |
|||
|volume=31 |
|||
|issue=7 |
|||
|pages=376–8 |
|||
|year=2006 |
|||
|month=July |
|||
|pmid=16785801 |
|||
|doi=10.1097/01.rlu.0000222736.81365.63 |
|||
}}</ref> Hos en person som allerede har demens, synes SPECT å være overlegen i å differensiere Alzheimers sykdom fra andre mulige årsaker, sammenlignet med de vanlige metodene for mental testing og analyse av personens [[Anamnese|medisinske historie]]. <ref name="pmid15545324">{{cite journal |
|||
|author=Dougall NJ, Bruggink S, Ebmeier KP |
|||
|title=Systematic review of the diagnostic accuracy of 99mTc-HMPAO-SPECT in dementia |
|||
|journal=Am J Geriatr Psychiatry |
|||
|volume=12 |
|||
|issue=6 |
|||
|pages=554–70 |
|||
|year=2004 |
|||
|pmid=15545324 |
|||
|doi=10.1176/appi.ajgp.12.6.554 |
|||
}}</ref> Fremskritt har ført til forslag om nye diagnostiske kriterier. <ref name="pmid17222085"></ref> <ref name="pmid17616482"></ref> |
|||
En ny teknikk som kalles PiB PET har blitt utviklet for direkte og tydelig bildebehandling av beta-amyloid-avleiringer in vivo ved hjelp av en tracer som binder seg selektivt til A-beta-avleiringer. <ref> PiB PET: |
|||
*{{cite journal |
|||
|author=Kemppainen NM, Aalto S, Karrasch M, ''et al.'' |
|||
|title=Cognitive reserve hypothesis: Pittsburgh Compound B and fluorodeoxyglucose positron emission tomography in relation to education in mild Alzheimer's disease |
|||
|journal=Ann. Neurol. |
|||
|volume=63 |
|||
|issue=1 |
|||
|pages=112–8 |
|||
|year=2008 |
|||
|month=January |
|||
|pmid=18023012 |
|||
|doi=10.1002/ana.21212 |
|||
}} |
|||
*{{cite journal |
|||
|author=Ikonomovic MD, Klunk WE, Abrahamson EE, ''et al.'' |
|||
|title=Post-mortem correlates of in vivo PiB-PET amyloid imaging in a typical case of Alzheimer's disease |
|||
|journal=Brain |
|||
|volume=131 |
|||
|issue=Pt 6 |
|||
|pages=1630–45 |
|||
|year=2008 |
|||
|month=June |
|||
|pmid=18339640 |
|||
|pmc=2408940 |
|||
|doi=10.1093/brain/awn016 |
|||
|last12=Hope |
|||
|first12=CE |
|||
|last13=Isanski |
|||
|first13=BA |
|||
|last14=Hamilton |
|||
|first14=RL |
|||
|last15=Dekosky |
|||
|first15=ST |
|||
}} |
|||
*{{cite journal |
|||
|author=Jack CR, Lowe VJ, Senjem ML, ''et al.'' |
|||
|title=11C PiB and structural MRI provide complementary information in imaging of Alzheimer's disease and amnestic mild cognitive impairment |
|||
|journal=Brain |
|||
|volume=131 |
|||
|issue=Pt 3 |
|||
|pages=665–80 |
|||
|year=2008 |
|||
|month=March |
|||
|pmid=18263627 |
|||
|doi=10.1093/brain/awm336 |
|||
|pmc=2730157 |
|||
}} </ ref>PiB-PET forbindelsen bruker karbon-11 PET-skanning. Nyere studier tyder på at PiB-PET kan forutsi med 86 % nøyaktighet om personer med mild kognitiv svekkelse vil utvikle Alzheimers sykdom innen to år, og 92 % nøyaktighet å utelukke sannsynligheten for å utvikle Alzheimers. <ref>{{cite journal |
|||
|author=Abella HA |
|||
|title=Report from SNM: PET imaging of brain chemistry bolsters characterization of dementias |
|||
|journal=Diagnostic Imaging |date=June 16, 2009 |
|||
|url=http://www.diagnosticimaging.com/imaging-trends-advances/cardiovascular-imaging/article/113619/1423022 |
|||
}}</ref> |
|||
Et lignende radiofarmasøytisk stoff for PET-skanning kalt (E) -4 - (2 - (6 - (2 - (2 - (2 - <sup>([18</sup> F]-fluoroethoxy) ethoxy) ethoxy) pyridin-3-yl) vinyl)-N -metyl benzenamine, eller <sup>18</sup> F AV-45, eller florbetapir-fluor-18, eller bare florbetapir som inneholder mer langvarig radionuklide fluor-18 har nylig blitt utviklet og testet som et mulig diagnostisk verktøy for Alzheimers. <ref>{{cite journal |
|||
|journal=Q J Nucl Med Mol Imaging |
|||
|date=2009 Aug |
|||
|volume=53 |
|||
|issue=4 |
|||
|pages=387–93 |
|||
|title=The use of the exploratory IND in the evaluation and development of <sup>18</sup>F-PET radiopharmaceuticals for amyloid imaging in the brain: a review of one company's experience |
|||
|author=Carpenter AP Jr, Pontecorvo MJ, Hefti FF, Skovronsky DM |
|||
|pmid=19834448 |
|||
}}</ref> <ref>{{cite web |author=Leung K |url=http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=micad&part=AV-45-18F |title=(E)-4-(2-(6-(2-(2-(2-(<sup>18</sup>F-fluoroethoxy)ethoxy)ethoxy)pyridin-3-yl)vinyl)-N-methyl benzenamine <nowiki>[[</nowiki><sup>18</sup>F<nowiki>]AV-45]</nowiki> |work=Molecular Imaging and Contrast Agent Database |date=April 8, 2010 |accessdate=2010-06-24}}</ref> <ref>{{cite news |
|||
|author=[[Gina Kolata|Kolata G]] |
|||
|url=http://www.nytimes.com/2010/06/24/health/research/24scans.html |
|||
|title=Promise Seen for Detection of Alzheimer's |
|||
|work=[[The New York Times]] |
|||
|date=June 23, 2010 |
|||
|accessdate=June 23, 2010 |
|||
}}</ref> <ref name="pmid20501908">{{cite journal |doi=10.2967/jnumed.109.069088 |journal=J Nucl Med |date=2010 Jun |volume=51 |issue=6 |pages=913–20 |title=In vivo imaging of amyloid deposition in Alzheimer disease using the radioligand 18F-AV-45 (flobetapir F 18) |author=Wong DF, Rosenberg PB, Zhou Y, Kumar A, Raymont V, Ravert HT, Dannals RF, Nandi A, Brasić JR, Ye W, Hilton J, Lyketsos C, Kung HF, Joshi AD, Skovronsky DM, Pontecorvo MJ |pmid=20501908 |laysummary=http://www.diagnosticimaging.com/news/display/article/113619/1598949 }}</ref> Florbetapir, som PiB, binder seg til beta-amyloid, men på grunn av bruken av fluor-18 har det en halveringstid på 110 minutter, i motsetning til PiBs radioaktive halveringstid på 20 minutter. Wong ''et al.'' fant at jo lenger levetid for traceren, jo mer akkumuleres den i hjernen til Alzheimer-pasientene, særlig i regionene kjent for å være assosiert med beta-amyloid avleiringer. <ref name="pmid20501908"></ref> |
|||
En systematisk oversikt spådde at amyloid-bildeteknikker sannsynligvis vil bli brukt sammen med andre markører snarere enn som et alternativ. <ref name="pmid19847050">{{cite journal |
|||
|author=Rabinovici GD, Jagust WJ |
|||
|journal=Behav Neurol |
|||
|year=2009 |
|||
|volume=21 |
|||
|issue=1 |
|||
|pages=117–28 |
|||
|title=Amyloid imaging in aging and dementia: testing the amyloid hypothesis in vivo |
|||
|pmid=19847050 |
|||
|pmc=2804478 |
|||
|doi=10.3233/BEN-2009-0232 |
|||
|doi_brokendate=2010-08-25 |
|||
}}</ref> |
|||
Volumetrisk [[Magnetresonanstomografi|MR]] kan oppdage endringer i størrelsen av hjerneregioner. Måling av de regionene som atrofierer under utvikling av Alzheimers sykdom er lovende som en diagnostisk indikator. Den kan vise seg billigere enn andre bildemetoder. <ref name="pmid18445747">{{cite journal |
|||
|author=O'Brien JT |
|||
|title=Role of imaging techniques in the diagnosis of dementia |
|||
|journal=Br J Radiol |
|||
|date=2007 Dec |
|||
|volume=80 |issue=Spec No 2 |pages=S71–7 |
|||
|pmid=18445747 |
|||
|doi=10.1259/bjr/33117326 |
|||
}}</ref> |
|||
Nyere studier tyder på at metabolitt-nivåer i hjernen kan brukes som biomarkører for Alzheimers sykdom. <ref name="pmid 19501936">{{cite journal |
|||
|author=Rupsingh R, Borrie M, Smith M, Wells JL, Bartha R |
|||
|title=Reduced hippocampal glutamate in Alzheimer disease |
|||
|journal=[[Neurobiol Aging]] |
|||
|year=2009 |
|||
|month=June |
|||
|pmid=19501936 |
|||
|doi=10.1016/j.neurobiolaging.2009.05.002 |
|||
}}</ref> |
|||
==Forebygging== |
|||
[[File:Honoré Daumier 032.jpg|right|thumb|Intellektuelle aktiviteter som å spille sjakk eller vanlig sosial interaksjon har vært knyttet til en redusert risiko for Alzheimers i epidemiologiske studier, men ingen årsakssammenheng er funnet.]] |
|||
I dag er det ingen definitive bevis som støtter at noe bestemt tiltak er effektivt i å forebygge Alzheimers <ref> Forebyggingstiltak som ikke er støttet: |
|||
* {{cite journal |author=Kawas CH |title=Medications and diet: protective factors for AD? |journal=Alzheimer Dis Assoc Disord |volume=20 |issue=3 Suppl 2 |pages=S89–96 |year=2006 |pmid=16917203|doi=}} |
|||
* {{cite journal |author=Luchsinger JA, Mayeux R |title=Dietary factors and Alzheimer's disease |journal=Lancet Neurol |volume=3 |issue=10 |pages=579–87 |year=2004 |pmid=15380154 |doi=10.1016/S1474-4422(04)00878-6}} |
|||
* {{cite journal |author=Luchsinger JA, Noble JM, Scarmeas N |title=Diet and Alzheimer's disease |journal=Curr Neurol Neurosci Rep |volume=7 |issue=5 |pages=366–72 |year=2007 |pmid=17764625 |doi=10.1007/s11910-007-0057-8}} |
|||
* {{cite press release |url=http://www.nih.gov/news/health/apr2010/od-28.htm |title=Independent Panel Finds Insufficient Evidence to Support Preventive Measures for Alzheimer's Disease |date=April 28, 2010 |publisher=[[National Institutes of Health]] }} |
|||
* {{cite web |url=http://consensus.nih.gov/2010/alzstatement.htm |title=NIH State-of-the-Science Conference: Preventing Alzheimer's Disease and Cognitive Decline |date=April 26–28, 2010 |author=Daviglus ML ''et al.''}} </ ref> Globale studier av tiltak for å hindre eller forsinke utbruddet av Alzheimers har ofte gitt inkonsekvente resultater. |
|||
Epidemiologiske studier har imidlertid foreslått sammenhenger mellom visse modifiserbare faktorer, som kosthold, kardiovaskulær risiko, farmasøytiske produkter eller intellektuelle aktiviteter blant annet, og en populasjons sannsynlighet for å utvikle Alzheimers. Bare videre forskning, herunder kliniske studier, vil avdekke om disse faktorene kan bidra til å forebygge Alzheimers. <ref> |
|||
{{cite journal |
|||
|author=Szekely CA, Breitner JC, Zandi PP |
|||
|title=Prevention of Alzheimer's disease |
|||
|journal=Int Rev Psychiatry |
|||
|volume=19 |
|||
|issue=6 |
|||
|pages=693–706 |
|||
|year=2007 |
|||
|pmid=18092245 |
|||
|doi=10.1080/09540260701797944 |
|||
}}</ref> |
|||
Selv om kardiovaskulære risikofaktorer, som for eksempel hyperkolesterolemi, [[Hypertensjon|hypertensjon]], diabetes og røyking er assosiert med en høyere risiko for start og forløp av Alzheimers, <ref name="pmid18299540">{{cite journal |
|||
|author=Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD |
|||
|title=Diagnosis and treatment of dementia: 1. Risk assessment and primary prevention of Alzheimer disease |
|||
|journal=CMAJ |
|||
|volume=178 |
|||
|issue=5 |
|||
|pages=548–56 |
|||
|year=2008 |
|||
|month=February |
|||
|pmid=18299540 |
|||
|pmc=2244657 |
|||
|doi=10.1503/cmaj.070796 |
|||
}}</ref> <ref name="pmid17483665">{{cite journal |
|||
|author=Rosendorff C, Beeri MS, Silverman JM |
|||
|title=Cardiovascular risk factors for Alzheimer's disease |
|||
|journal=Am J Geriatr Cardiol |
|||
|volume=16 |
|||
|issue=3 |
|||
|pages=143–9 |
|||
|year=2007 |
|||
|pmid=17483665 |
|||
|doi=10.1111/j.1076-7460.2007.06696.x |
|||
}}</ref> har ikke statiner, som er [[Kolesterol|kolesterolsenkende]] medisiner vært effektive i å forebygge eller bedre sykdommen. <ref name="pmid17927279">{{cite journal |
|||
|author=Reiss AB, Wirkowski E |
|||
|title=Role of HMG-CoA reductase inhibitors in neurological disorders: progress to date |
|||
|journal=Drugs |
|||
|volume=67 |
|||
|issue=15 |
|||
|pages=2111–20 |
|||
|year=2007 |
|||
|pmid=17927279|doi=10.2165/00003495-200767150-00001 |
|||
}}</ref> <ref name="pmid17877925">{{cite journal |
|||
|author=Kuller LH |
|||
|title=Statins and dementia |
|||
|journal=Curr Atheroscler Rep |
|||
|volume=9 |
|||
|issue=2 |
|||
|pages=154–61 |
|||
|year=2007 |
|||
|month=August |
|||
|pmid=17877925 |
|||
|doi=10.1007/s11883-007-0012-9 |
|||
}}</ref> Komponentene i en middelhavsdiett, som inkluderer frukt og grønnsaker, [[Brød|brød]], [[Hveteslekten|hvete]] og andre [[Korn|kornprodukter]], [[Olivenolje|olivenolje]], [[Fisk|fisk]] og rødvin, kan alle individuelt, eller sammen, redusere risikoen og forløpet av Alzheimers sykdom. <ref name="pmid18088206">{{cite journal |
|||
|author=Solfrizzi V, Capurso C, D'Introno A, ''et al.'' |
|||
|title=Lifestyle-related factors in predementia and dementia syndromes |
|||
|journal=Expert Rev Neurother |
|||
|volume=8 |
|||
|issue=1 |
|||
|pages=133–58 |
|||
|year=2008 |
|||
|month=January |
|||
|pmid=18088206 |
|||
|doi=10.1586/14737175.8.1.133 |
|||
|url= |
|||
}}</ref> Den gunstige kardiovaskulære effekten har vært foreslått som virkningsmekanismen. <ref name="pmid18088206"></ref> Det er begrenset dokumentasjon på at lett til moderat bruk av alkohol, særlig rødvin, er forbundet med lavere risiko for Alzheimers. <ref>{{cite journal |
|||
|author=Panza F, Capurso C, D'Introno A, Colacicco AM, Frisardi V, Lorusso M, Santamato A, Seripa D, Pilotto A, Scafato E, Vendemiale G, Capurso A, Solfrizzi V. |
|||
|title=Alcohol drinking, cognitive functions in older age, predementia, and dementia syndromes |
|||
|journal=J Alzheimers Dis |
|||
|volume=17 |
|||
|issue=1 |
|||
|pages=7–31 |
|||
|date=May 2009 |
|||
|pmid=19494429 |
|||
|doi=10.3233/JAD-2009-1009 |
|||
|last12=Capurso |
|||
|first12=A |
|||
|last13=Solfrizzi |
|||
|first13=V |
|||
|doi_brokendate=2010-08-25 |
|||
}}</ref> |
|||
Vurderinger om bruk av [[Vitamin|vitamin]]er har ikke funnet nok bevis for effekt til å anbefale vitamin C, <ref name="pmid16227450">{{cite journal |
|||
|author=Boothby LA, Doering PL |
|||
|title=Vitamin C and vitamin E for Alzheimer's disease |
|||
|journal=Ann Pharmacother |
|||
|volume=39 |
|||
|issue=12 |
|||
|pages=2073–80 |
|||
|year=2005 |
|||
|month=December |
|||
|pmid=16227450 |
|||
|doi=10.1345/aph.1E495 |
|||
|url= |
|||
}}</ref> E, <ref name="pmid16227450"></ref> <ref>{{cite journal |
|||
|author=Isaac MG, Quinn R, Tabet N |
|||
|title=Vitamin E for Alzheimer's disease and mild cognitive impairment |
|||
|journal=Cochrane Database Syst Rev |
|||
|volume= |
|||
|issue=3 |
|||
|pages=CD002854 |
|||
|year=2008 |
|||
|pmid=18646084 |
|||
|doi=10.1002/14651858.CD002854.pub2 |
|||
|url= |
|||
}}</ref> eller folinsyre med eller uten vitamin <sub>12</sub> B, <ref>{{cite journal |
|||
|author=Malouf R, Grimley Evans J |
|||
|title=Folic acid with or without vitamin B<sub>12</sub> for the prevention and treatment of healthy elderly and demented people |
|||
|journal=Cochrane Database Syst Rev |
|||
|volume= |
|||
|issue=4 |
|||
|pages=CD004514 |
|||
|year=2008 |
|||
|pmid=18843658 |
|||
|doi=10.1002/14651858.CD004514.pub2 |
|||
|url= |
|||
}}</ref> som forebygging eller behandling av Alzheimers. I tillegg er vitamin E knyttet til viktige helserisikoer. <ref name="pmid16227450"></ref> Studier som har undersøkt folat (B9) og andre B-vitaminer klarte ikke å vise noen signifikant sammenheng med kognitiv svikt. <ref>{{cite journal |
|||
|title=Effect of folic acid, with or without other B vitamins, on cognitive decline: meta-analysis of randomized trials |
|||
|author=Wald DS, Kasturiratne A, Simmonds M |
|||
|journal=[[The American Journal of Medicine]] |
|||
|date=June 2010 |
|||
|volume=123 |
|||
|pmid=20569758 |
|||
|issue=6 |
|||
|pages=522–527.e2 |
|||
|doi=10.1016/j.amjmed.2010.01.017 |
|||
|pii=S0002-9343(10)00131-2 |
|||
}}</ref> |
|||
Langsiktig bruk av [[Ikkesteroid antiinflammatorisk middel|ikke-steroide anti-inflammatoriske medikamenter]] (NSAIDs) er assosiert med en redusert sannsynlighet for å utvikle Alzheimers. <ref name="pmid17612054">{{cite journal |
|||
|author=Szekely CA, Town T, Zandi PP |
|||
|title=NSAIDs for the chemoprevention of Alzheimer's disease |
|||
|journal=Subcell Biochem |
|||
|volume=42 |
|||
|issue= |
|||
|pages=229–48 |
|||
|year=2007 |
|||
|month= |
|||
|pmid=17612054 |
|||
|doi=10.1007/1-4020-5688-5_11 |
|||
}}</ref> Humane post mortem-studier, i dyremodeller, eller [[In vitro|in vitro]]-undersøkelser støtter også tanken om at NSAIDs kan redusere betennelser relatert til amyloid plakk. <ref name="pmid17612054"></ref> Men studier som undersøker deres bruk som palliativ behandling har ikke klart å vise positive resultater, og ingen forebyggingsforsøk er ennå avsluttet. <ref name="pmid17612054"></ref> Curcumin fra [[Curry|karri]]krydderet [[Gurkemeie|gurkemeie]] har vist noe effekt i å forebygge hjerneskade hos mus på grunn av sine anti-inflammatoriske egenskaper. <ref>{{cite journal |
|||
|author=Ringman JM, Frautschy SA, Cole GM, Masterman DL, Cummings JL |
|||
|title=A potential role of the curry spice curcumin in Alzheimer's disease |
|||
|journal=Curr Alzheimer Res |
|||
|issn=1567-2050 |
|||
|volume=2 |
|||
|issue=2 |
|||
|pages=131–6 |
|||
|year=2005 |
|||
|month=April |
|||
|pmid=15974909 |
|||
|pmc=1702408 |
|||
|doi=10.2174/1567205053585882 |
|||
}}</ref> <ref>{{cite journal |
|||
|author=Aggarwal BB, Harikumar KB |
|||
|title=Potential therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary, metabolic, autoimmune and neoplastic diseases |
|||
|journal=Int J Biochem Cell Biol |
|||
|volume=41 |
|||
|issue=1 |
|||
|pages=40–59 |
|||
|year=2009 |
|||
|month=January |
|||
|pmid=18662800 |
|||
|doi=10.1016/j.biocel.2008.06.010 |
|||
|pmc=2637808 |
|||
}}</ref> Hormonbehandling, som tidligere ble brukt, antas ikke lenger å forebygge demens, og i noen tilfeller kan det også være relatert til demens. <ref name="pmid19370593">{{cite journal |
|||
|author=Farquhar C, Marjoribanks J, Lethaby A, Suckling JA, Lamberts Q |
|||
|title=Long term hormone therapy for perimenopausal and postmenopausal women |
|||
|journal=Cochrane Database Syst Rev |
|||
|volume= |
|||
|issue=2 |
|||
|pages=CD004143 |
|||
|date=15 April 2009 |
|||
|pmid=19370593 |
|||
|doi=10.1002/14651858.CD004143.pub3 |
|||
}}</ref> <ref name="pmid19401958">{{cite journal |
|||
|author=Barrett-Connor E, Laughlin GA |
|||
|title=Endogenous and exogenous estrogen, cognitive function, and dementia in postmenopausal women: evidence from epidemiologic studies and clinical trials |
|||
|journal=Semin Reprod Med |
|||
|volume=27 |
|||
|issue=3 |
|||
|date=May 2009 |
|||
|pages=275–82 |
|||
|pmc=2701737 |
|||
|doi=10.1055/s-0029-1216280 |
|||
|pmid=19401958 |
|||
|last1=Barrett-Connor |
|||
|first1=E |
|||
|last2=Laughlin |
|||
|first2=GA |
|||
}}</ref> Det er inkonsekvent og lite overbevisende dokumentasjon for at ginkgo har noen positiv effekt på kognitiv svikt og demens, <ref>{{cite journal |
|||
|author=Birks J, Grimley Evans J |
|||
|title=Ginkgo biloba for cognitive impairment and dementia |
|||
|journal=Cochrane Database Syst Rev |
|||
|volume= |
|||
|issue=1 |
|||
|pages=CD003120 |
|||
|year=2009 |
|||
|pmid=19160216 |
|||
|doi=10.1002/14651858.CD003120.pub3 |
|||
|url= http://mrw.interscience.wiley.com/cochrane/clsysrev/articles/CD003120/frame.html |
|||
|accessdate=2009-08-13 |
|||
}}</ref> og en fersk undersøkelse konkluderer med at det ikke har noen effekt i å redusere forekomsten av Alzheimers. <ref>{{cite journal |
|||
|author=DeKosky ST, Williamson JD, Fitzpatrick AL ''et al.'' |
|||
|title=Ginkgo biloba for Prevention of Dementia |
|||
|journal=Journal of the American Medical Association |
|||
|year=2008 |
|||
|volume=300 |
|||
|issue=19 |
|||
|pages=2253–2262 |
|||
|pmid=19017911 |
|||
|doi=10.1001/jama.2008.683 |
|||
|url=http://jama.ama-assn.org/cgi/content/full/300/19/2253 |
|||
|accessdate=2008-11-18 |
|||
|last12=Robbins |
|||
|first12=JA |
|||
|last13=Tracy |
|||
|first13=RP |
|||
|last14=Woolard |
|||
|first14=NF |
|||
|last15=Dunn |
|||
|first15=L |
|||
|last16=Snitz |
|||
|first16=BE |
|||
|last17=Nahin |
|||
|first17=RL |
|||
|last18=Furberg |
|||
|first18=CD |
|||
|last19=Ginkgo Evaluation Of Memory (Gem) Study |
|||
|first19=Investigators |
|||
|pmc=2823569 |
|||
}}</ref> En studie over 21 år fant at kaffedrikkere som drakk 3-5 kopper per dag midt i livet, hadde en 65 % reduksjon i risiko for demens sent i livet. <ref>{{cite journal |
|||
|author=Eskelinen MH, Ngandu T, Tuomilehto J, Soininen H, Kivipelto M |
|||
|title=Midlife coffee and tea drinking and the risk of late-life dementia: a population-based CAIDE study |
|||
|journal=J Alzheimers Dis |
|||
|volume=16 |
|||
|issue=1 |
|||
|pages=85–91 |
|||
|year=2009 |
|||
|month=January |
|||
|pmid=19158424 |
|||
|doi=10.3233/JAD-2009-0920 |
|||
|doi_brokendate=2010-08-25 |
|||
}}</ref> |
|||
Personer som deltar i intellektuelle aktiviteter som lesing, spiller brettspill, fyller ut kryssord, spiller [[Musikkinstrument|musikkinstrumenter]] eller deltar i vanlig sosialt interaksjon, viser en redusert risiko for Alzheimers sykdom. <ref name="pmid16917199">{{cite pmid|16917199}}</ref> Dette er kompatibelt med kognitiv reserve-teorien, som sier at noen livserfaringer resulterer i mer effektiv nevral funksjon som gir den enkelte en kognitiv reserve som forsinker utbruddet av demens-manifestasjoner. <ref name="pmid16917199"></ref> Utdanning forsinker utbruddet av Alzheimers syndrom, men er ikke relatert til tidligere død etter diagnose. <ref name="pmid19026089">{{cite journal |
|||
|author=Paradise M, Cooper C, Livingston G |
|||
|title=Systematic review of the effect of education on survival in Alzheimer's disease |
|||
|journal=Int Psychogeriatr |
|||
|volume=21 |
|||
|issue=1 |
|||
|pages=25–32 |
|||
|year=2009 |
|||
|month=February |
|||
|pmid=19026089 |
|||
|doi=10.1017/S1041610208008053 |
|||
}}</ref> Fysisk aktivitet er også forbundet med redusert risiko for Alzheimers. <ref name="pmid19026089"></ref> |
|||
Noen studier har vist en økt risiko for å utvikle Alzheimers ved miljøfaktorer som inntak av [[Metall|metall]]er, spesielt [[Aluminium|aluminium]] <ref name="pmid17522444">{{cite journal |
|||
|author=Shcherbatykh I, Carpenter DO |
|||
|title=The role of metals in the etiology of Alzheimer's disease |
|||
|journal=J Alzheimers Dis |
|||
|volume=11 |
|||
|issue=2 |
|||
|pages=191–205 |
|||
|year=2007 |
|||
|month=May |
|||
|pmid=17522444 |
|||
}}</ref> <ref>{{cite journal |
|||
|author=Rondeau V, Commenges D, Jacqmin-Gadda H, Dartigues JF |
|||
|title=Relation between aluminum concentrations in drinking water and Alzheimer's disease: an 8-year follow-up study |
|||
|journal=Am J Epidemiol |
|||
|volume=152 |
|||
|issue=1 |
|||
|pages=59–66 |
|||
|year=2000 |
|||
|month=July |
|||
|pmid=10901330 |
|||
|pmc=2215380 |
|||
|doi=10.1093/aje/152.1.59 |
|||
}}</ref> eller eksponering for [[Løsemiddel|løsemidler]]. <ref name="pmid7771442">{{cite journal |
|||
|author=Kukull WA, Larson EB, Bowen JD, ''et al.'' |
|||
|title=Solvent exposure as a risk factor for Alzheimer's disease: a case-control study |
|||
|journal=Am J Epidemiol |
|||
|volume=141 |
|||
|issue=11 |
|||
|pages=1059–71; discussion 1072–9 |
|||
|year=1995 |
|||
|month=June |
|||
|pmid=7771442 |
|||
}}</ref> Kvaliteten på noen av disse studiene har vært kritisert, <ref>{{cite journal |
|||
|author=Santibáñez M, Bolumar F, García AM |
|||
|title=Occupational risk factors in Alzheimer's disease: a review assessing the quality of published epidemiological studies |
|||
|journal=Occupational and Environmental Medicine |
|||
|volume=64 |
|||
|issue=11 |
|||
|pages=723–732 |
|||
|year=2007 |
|||
|pmid=17525096 |
|||
|doi=10.1136/oem.2006.028209 |
|||
}}</ref> og andre studier har konkludert med at det ikke er noen sammenheng mellom disse miljømessige faktorene og utviklingen av Alzheimers. <ref>{{cite journal |
|||
|author=Seidler A, Geller P, Nienhaus A, ''et al.'' |
|||
|title=Occupational exposure to low frequency magnetic fields and dementia: a case-control study |
|||
|journal=Occup Environ Med |
|||
|volume=64 |
|||
|issue=2 |
|||
|pages=108–14 |
|||
|year=2007 |
|||
|month=February |
|||
|pmid=17043077 |
|||
|doi=10.1136/oem.2005.024190 |
|||
|pmc=2078432 |
|||
}}</ref> <ref name="pmid12222737">{{cite journal |
|||
|author=Rondeau V |
|||
|title=A review of epidemiologic studies on aluminum and silica in relation to Alzheimer's disease and associated disorders |
|||
|journal=Rev Environ Health |
|||
|volume=17 |
|||
|issue=2 |
|||
|pages=107–21 |
|||
|year=2002 |
|||
|pmid=12222737 |
|||
}}</ref> <ref name="pmid9115023">{{cite journal |
|||
|author=Martyn CN, Coggon DN, Inskip H, Lacey RF, Young WF |
|||
|title=Aluminum concentrations in drinking water and risk of Alzheimer's disease |
|||
|journal=Epidemiology |
|||
|volume=8 |
|||
|issue=3 |
|||
|pages=281–6 |
|||
|year=1997 |
|||
|month=May |
|||
|pmid=9115023 |
|||
|doi=10.1097/00001648-199705000-00009 |
|||
}}</ref> <ref name="pmid9861186">{{cite journal |
|||
|author=Graves AB, Rosner D, Echeverria D, Mortimer JA, Larson EB |
|||
|title=Occupational exposures to solvents and aluminium and estimated risk of Alzheimer's disease |
|||
|journal=Occup Environ Med |
|||
|volume=55 |
|||
|issue=9 |
|||
|pages=627–33 |
|||
|year=1998 |
|||
|month=September |
|||
|pmid=9861186 |
|||
|pmc=1757634 |
|||
|doi=10.1136/oem.55.9.627 |
|||
}}</ref> |
|||
Mens noen studier antyder at [[Ekstremt lav frekvens|ekstremt lavfrekvente]] elektromagnetiske felt kan øke risikoen for Alzheimers sykdom, fant analytikere at ytterligere epidemiologiske og laboratorieundersøkelser av denne hypotesen er nødvendig. <ref>{{Cite document |title=Health Effects of Exposure to EMF |author=Scientific Committee on Emerging and Newly Identified Health Risks-SCENIHR|date=January 2009|publisher=Directorate General for Health&Consumers; European Commission |location=Brussels |pages=4–5 |url=http://ec.europa.eu/health/ph_risk/committees/04_scenihr/docs/scenihr_o_022.pdf |accessdate=2010-04-27 |postscript=<!--None-->}}</ref> Røyking er en betydelig Alzheimers risikofaktor. <ref>{{cite journal |
|||
|author=Cataldo JK, Prochaska JJ, Glantz SA |
|||
|title=Cigarette smoking is a risk factor for Alzheimer's disease: an analysis controlling for tobacco industry affiliation |
|||
|journal=J Alzheimers Dis |
|||
|year=2010 |
|||
|volume=19 |
|||
|issue=2 |
|||
|pages=465–80 |
|||
|pmid= 20110594 |
|||
|doi=10.3233/JAD-2010-1240 |
|||
|doi_brokendate=2010-08-25 |
|||
}}</ref> |
|||
Systemiske markører av det medfødte immunsystemet er risikofaktorer for sent innsettende Alzheimers. <ref>{{cite journal|last1=Eikelenboom|first1=P|last2=Van Exel|first2=E|last3=Hoozemans|first3=JJ|last4=Veerhuis|first4=R|last5=Rozemuller|first5=AJ|last6=Van Gool|first6=WA|title=Neuroinflammation - an early event in both the history and pathogenesis of Alzheimer's disease.|journal=Neuro-degenerative diseases|volume=7|issue=1-3|pages=38–41|year=2010|pmid=20160456|doi=10.1159/000283480}}</ref> |
|||
==Behandling== |
|||
Det finnes ingen kur for Alzheimers sykdom, tilgjengelige behandlinger tilbudt er av relativt liten symptomatisk nytte. Dagens behandling kan deles inn i farmasøytisk, psykososial og omsorg. |
|||
===Farmasøytisk=== |
|||
[[File:Donepezil 1EVE.png|right | thumb | Tre-dimensjonal molekylær modell av donepezil, en acetylkolinesterase-hemmer som brukes i behandling av Alzheimerssymptomer]] |
|||
[[File:Memantine.svg|right|thumb|upright|Molekylstrukturen til memantin, et godkjent medikament for langt fremskredne Alzheimers-symptomer]] |
|||
Fire medisiner er nå godkjent av offentlige instanser som for eksempel den amerikanske [[Food and Drug Administration|Food and Drug Administration]] (FDA) og [[Det europeiske legemiddelbyrået|European Medicines Agency]] (EMA) til å behandle kognitive manifestasjoner av Alzheimers: tre er acetylkolinesterase-hemmere og den siste er memantin, en NMDA-reseptor antagonist . Ingen medikamenter ser ut til å utsette eller stoppe utviklingen av sykdommen. |
|||
Reduksjon av aktiviteten i kolinerge nevroner er et velkjent trekk ved Alzheimers sykdom. <ref name="pmid8534419">{{cite journal |
|||
|author=Geula C, Mesulam MM |
|||
|title=Cholinesterases and the pathology of Alzheimer disease |
|||
|journal=[[Alzheimer Dis Assoc Disord]] |
|||
|volume=9 Suppl 2 |
|||
|pages=23–28 |
|||
|year=1995 |
|||
|pmid=8534419 |
|||
}}</ref> Acetylkolinesterase-hemmere brukes for å redusere hastigheten som [[Acetylkolin|acetylkolin]] (ACH) brytes ned med, og dermed øke konsentrasjonen av ACH i hjernen og bekjempe tapet av ACH forårsaket av døde kolinerge nevroner. <ref name="pmid11105732">{{cite journal |
|||
|doi=10.4088/JCP.v61n1101 |
|||
|author=Stahl SM |
|||
|title=The new cholinesterase inhibitors for Alzheimer's disease, Part 2: illustrating their mechanisms of action |
|||
|journal=[[J Clin Psychiatry]] |
|||
|volume=61 |
|||
|issue=11 |
|||
|pages=813–814 |
|||
|year=2000 |
|||
|pmid=11105732 |
|||
}}</ref> {{as of |
|||
| 2008}}. Kolinesterasehemmere godkjent for behandling av Alzheimers symptomer er donepezil (preparatnavn ''Aricept'' ) <ref>{{cite web |
|||
|url=http://www.nlm.nih.gov/medlineplus/druginfo/meds/a697032.html |
|||
|title=Donepezil |
|||
|accessdate=2010-02-03 |
|||
|date=2007-01-08 |
|||
|publisher=[[US National Library of Medicine]] |
|||
|work=[[Medline Plus]] |
|||
}}</ref>, galantamin (''Razadyne'' ) <ref>{{cite web |
|||
|url=http://www.nlm.nih.gov/medlineplus/druginfo/meds/a699058.html |
|||
|title=Galantamine |
|||
|accessdate=2010-02-03 |
|||
|date=2007-01-08 |
|||
|publisher=[[US National Library of Medicine]] |
|||
|work=[[Medline Plus]] |
|||
}}</ref> og rivastigmin (preparat ''Exelon'' <ref>{{cite web |
|||
|url=http://www.nlm.nih.gov/medlineplus/druginfo/meds/a602009.html |
|||
|title=Rivastigmine |
|||
|accessdate=2010-02-03 |
|||
|date=2007-01-08 |
|||
|publisher=[[US National Library of Medicine]] |
|||
|work=[[Medline Plus]] |
|||
}}</ref> og ''Exelon Patch'' <ref>{{cite web |
|||
|url=http://www.nlm.nih.gov/medlineplus/druginfo/meds/a607078.html |
|||
|title=Rivastigmine Transdermal |
|||
|accessdate=2010-02-03 |
|||
|date=2007-01-08 |
|||
|publisher=[[US National Library of Medicine]] |
|||
|work=[[Medline Plus]] |
|||
}}</ref> ). Det er dokumentasjon for effekten av disse medikamentene ved mild til moderat Alzheimers sykdom, <ref name="pmid16437532">{{cite journal |
|||
|author=Birks J |
|||
|title=Cholinesterase inhibitors for Alzheimer's disease |
|||
|journal=Cochrane Database Syst Rev |
|||
|issue=1 |
|||
|pages=CD005593 |
|||
|year=2006 |
|||
|pmid=16437532 |
|||
|doi=10.1002/14651858.CD005593 |
|||
|last2=Birks |
|||
|first2=Jacqueline |
|||
}}</ref> <ref name="pmid19370562">{{cite journal |
|||
|journal=[[Cochrane Database Syst Rev]] |
|||
|date=2009 Apr 15 |
|||
|pages=CD001191 |
|||
|issue=2 |
|||
|at=CD001191 |
|||
|title=Rivastigmine for Alzheimer's disease |
|||
|author=Birks J, Grimley Evans J, Iakovidou V, Tsolaki M, Holt FE |
|||
|pmid=19370562 |
|||
|doi=10.1002/14651858.CD001191.pub2 |
|||
}}</ref> og noe dokumentasjon for bruk i fremskredent stadium. Bare donepezil er godkjent for behandling av fremskreden Alzheimers demens. <ref name="pmid16437430">{{cite journal |
|||
|author=Birks J, Harvey RJ |
|||
|title=Donepezil for dementia due to Alzheimer's disease |
|||
|journal=[[Cochrane Database Syst Rev]] |
|||
|issue=1 |
|||
|pages=CD001190 |
|||
|date=2006 Jan 25 |
|||
|pmid=16437430 |
|||
|doi=10.1002/14651858.CD001190.pub2 |
|||
}}</ref> Bruken av disse legemidlene ved mild kognitiv svekkelse har ikke vist noen effekt i en forsinkelse på utbruddet av Alzheimers. <ref name="pmid18044984">{{cite journal |
|||
|author=Raschetti R, Albanese E, Vanacore N, Maggini M |
|||
|title=Cholinesterase inhibitors in mild cognitive impairment: a systematic review of randomised trials |
|||
|journal=[[PLoS Med]] |
|||
|volume=4 |
|||
|issue=11 |
|||
|pages=e338 |
|||
|year=2007 |
|||
|pmid=18044984 |
|||
|doi=10.1371/journal.pmed.0040338 |
|||
|pmc=2082649 |
|||
}}</ref> De vanligste bivirkningene er [[Kvalme og brekninger|kvalme]] og [[Oppkast|oppkast]] som begge er knyttet til kolinergt overskudd. Disse bivirkningene oppstår hos omtrent 10-20 % av pasientene og er milde til moderate i alvorlighetsgrad. Mindre vanlige bivirkninger er muskelkramper, [[Puls|nedsatt]] hjerterytme (bradykardi), redusert appetitt og vekt, og økt [[Magesaft|magesyre]]produksjon. <ref> Acetylcholinesterase inhibitors prescribing information: |
|||
*{{cite web |
|||
|url=http://www.aricept.com/images/AriceptComboFullPINovember02006.pdf |
|||
|form=pdf |
|||
|title=Aricept Prescribing information |
|||
|accessdate=2008-08-18 |
|||
|format= PDF |
|||
|publisher=Eisai and [[Pfizer]] |
|||
}} (primary source) |
|||
*{{cite web |
|||
|url=http://web.archive.org/web/20080528195504/http://razadyneer.com/razadyneer/pages/pdf/razadyne_er.pdf |
|||
|title=Razadyne ER U.S. Full Prescribing Information |
|||
|accessdate=2008-02-19 |
|||
|format=PDF |
|||
|publisher=[[Ortho-McNeil Neurologics]] |
|||
}} (primary source) |
|||
*{{cite web |
|||
|url=http://www.pharma.us.novartis.com/product/pi/pdf/exelonpatch.pdf |
|||
|archiveurl=http://web.archive.org/web/20070728014715/http://www.pharma.us.novartis.com/product/pi/pdf/exelonpatch.pdf |
|||
|archivedate=2007-07-28 |
|||
|title=Exelon ER U.S. Prescribing Information |
|||
|accessdate=2008-02-19 |
|||
|format=PDF |
|||
|publisher=[[Novartis Pharmaceuticals]] |
|||
}} (primary source) |
|||
*{{cite web |
|||
|url=http://www.accessdata.fda.gov/drugsatfda_docs/label/2006/020823s016,021025s008lbl.pdf |
|||
|archiveurl=http://web.archive.org/web/20070710074347/http://www.fda.gov/cder/foi/label/2006/020823s016,021025s008lbl.pdf |
|||
|archivedate=2007-07-10 |
|||
|title=Exelon U.S. Prescribing Information |
|||
|date=June 2006 |
|||
|accessdate=2009-07-30 |
|||
|format= PDF |
|||
|publisher=[[Novartis Pharmaceuticals]] |
|||
}} (primary source) |
|||
*{{cite web |
|||
|url=http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/EnforcementActivitiesbyFDA/WarningLettersandNoticeofViolationLetterstoPharmaceuticalCompanies/ucm054180.pdf |
|||
|format=PDF |
|||
|title=Exelon Warning Letter |
|||
|date=August 2007 |
|||
|accessdate=2009-07-30 |
|||
|publisher=[[US Food and Drug Administration]] |
|||
}} </ ref> |
|||
Glutamat er en nyttig eksitatorisk [[Nevrotransmitter|nevrotransmitter]] i [[Nervesystem|nervesystemet]] men store mengder i [[Hjerne|hjernen]] kan føre til [[Celle|celledød]] gjennom en prosess som kalles eksitotoksisitet som består av overstimulering av glutamatreseptorer. Eksitotoksisitet forekommer ikke bare ved Alzheimers sykdom, men også i andre nevrologiske sykdommer som [[Parkinsons sykdom|Parkinsons sykdom]] og [[Multippel sklerose|multippel sklerose]]. <ref name="pmid16424917">{{cite journal |
|||
|author=Lipton SA |
|||
|title=Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond |
|||
|journal=[[Nat Rev Drug Discov]] |
|||
|volume=5 |
|||
|issue=2 |
|||
|pages=160–170 |
|||
|year=2006 |
|||
|pmid=16424917 |
|||
|doi=10.1038/nrd1958 |
|||
}}</ref> Memantin (preparatnavn ''Akatinol, Axura, Ebixa'' / ''Abixa, Memox'' og ''Namenda'' ), <ref>{{cite web |
|||
|url=http://www.nlm.nih.gov/medlineplus/druginfo/meds/a604006.html |
|||
|title=Memantine |
|||
|accessdate=2010-02-03 |
|||
|date=2004-01-04 |
|||
|publisher= US National Library of Medicine (Medline) |
|||
}}</ref> er en nonkompetitiv NMDA-reseptor antagonist først brukt som et [[Influensa|anti-influensa]]-medikament. Det virker på det glutamaterge systemet ved å blokkere NMDA-reseptorer og hemme deres overstimulering av glutamat. <ref name="pmid16424917"></ref> Memantin har vist seg å være moderat effektiv i behandling av moderat til alvorlig Alzheimers sykdom. Effektene i de første stadiene av Alzheimers er ukjent. <ref name="pmid15495043">{{cite journal |
|||
|author=Areosa Sastre A, McShane R, Sherriff F |
|||
|title=Memantine for dementia |
|||
|journal=[[Cochrane Database Syst Rev]] |
|||
|issue=4 |
|||
|pages=CD003154 |
|||
|year=2004 |
|||
|pmid=15495043 |
|||
|doi=10.1002/14651858.CD003154.pub2 |
|||
}}</ref> Rapporterte bivirkninger med memantin er sjeldne og milde, inkludert [[Hallusinasjon|hallusinasjon]]er, forvirring, [[Svimmelhet|svimmelhet]], [[Hodepine|hodepine]] og tretthet. <ref> {{cite web |
|||
|url=http://www.frx.com/pi/namenda_pi.pdf |
|||
|title=Namenda Prescribing Information |
|||
|accessdate=2008-02-19 |
|||
|format=PDF |
|||
|publisher=[[Forest Pharmaceuticals]] |
|||
}} (primærkilden)</ref> Kombinasjonen av memantin og donepezil har vist seg å ha "[[Statistisk signifikans|statistisk signifikant]], men klinisk marginal effekt". <ref name="pmid18316756">{{cite journal |
|||
|author=Raina P, Santaguida P, Ismaila A, ''et al.'' |
|||
|title=Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline |
|||
|journal=[[Annals of Internal Medicine]] |
|||
|volume=148 |
|||
|issue=5 |
|||
|pages=379–397 |
|||
|year=2008 |
|||
|pmid=18316756 |
|||
}}</ref> |
|||
[[Antipsykotika|Antipsykotiske]] legemidler er beskjedent nyttige for å redusere [[Aggresjon|aggresjon]] og [[Psykose|psykose]] hos alzheimerspasienter med atferdsproblemer, men er forbundet med alvorlige bivirkninger, for eksempel cerebrovaskulære hendelser, bevegelses-vanskelighet eller kognitiv svikt, som ikke tillater at de brukes rutinemessig. <ref> Antipsychotics use: |
|||
*{{cite journal |
|||
|author=Ballard C, Waite J |
|||
|title=The effectiveness of atypical antipsychotics for the treatment of aggression and psychosis in Alzheimer's disease |
|||
|journal=[[Cochrane Database Syst Rev]] |
|||
|issue=1 |
|||
|pages=CD003476 |
|||
|year=2006 |
|||
|pmid=16437455 |
|||
|doi=10.1002/14651858.CD003476.pub2}} |
|||
*{{cite journal |
|||
|author=Ballard C, Lana MM, Theodoulou M, ''et al.'' |
|||
|title=A randomised, blinded, placebo-controlled trial in dementia patients continuing or stopping neuroleptics (The DART-AD trial) |
|||
|journal=[[PLoS Med]] |
|||
|volume=5 |
|||
|issue=4 |
|||
|pages=e76 |
|||
|year=2008 |
|||
|pmid=18384230 |
|||
|doi=10.1371/journal.pmed.0050076 |
|||
|pmc=2276521 |
|||
}} |
|||
*{{cite journal |
|||
|author=Sink KM, Holden KF, Yaffe K |
|||
|title=Pharmacological treatment of neuropsychiatric symptoms of dementia: a review of the evidence |
|||
|journal=[[J Am Med Assoc]] |
|||
|volume=293 |
|||
|issue=5 |
|||
|pages=596–608 |
|||
|year=2005 |
|||
|pmid=15687315 |
|||
|doi=10.1001/jama.293.5.596 |
|||
}} </ ref> <ref name="pmid19138567"> |
|||
{{cite journal |
|||
|author=Ballard C, Hanney ML, Theodoulou M, Douglas S, McShane R, Kossakowski K, Gill R, Juszczak E, Yu L-M, Jacoby R |
|||
|title=The dementia antipsychotic withdrawal trial (DART-AD): long-term follow-up of a randomised placebo-controlled trial |
|||
|journal=[[Lancet Neurology]] |
|||
|date=9 January 2009 |
|||
|pmid=19138567 |
|||
|doi=10.1016/S1474-4422(08)70295-3 |
|||
|laysummary=http://www.physorg.com/news150695213.html |
|||
|volume=8 |
|||
|page=151 |
|||
|issue=2 |
|||
}}</ref> Når de brukes på lang sikt, har de vist seg å være assosiert med økt dødelighet. <ref name="pmid19138567"></ref> |
|||
Medisinsk marihuana synes å være effektiv i å forsinke Alzheimers sykdom. Den aktive ingrediensen i marihuana, THC, hindrer dannelse av avleiringer i hjernen assosiert med Alzheimers sykdom. THC ble funnet å hemme acetylcholinesterase mer effektivt enn kommersielt markedsførte legemidler. THC ble også funnet å forsinke amylogenese. <ref>{{Cite journal|author=Eubanks LM, Rogers CJ, Beuscher AE, ''et al.'' |title=A molecular link between the active component of marijuana and Alzheimer's disease pathology |journal=Molecular Pharmaceutics |volume=3 |issue=6 |pages=773–7 |year=2006 |pmid=17140265 |pmc=2562334 |doi=10.1021/mp060066m |month= November|issn=1543-8384 |format=Free full text}}</ref> <ref>{{cite journal |journal=[[Br J Pharmacol]] |volume=152 |issue=5 |pages=655–62 |date=2007 November |doi=10.1038/sj.bjp.0707446 |pmc=2190031 |pmid=17828287 |title=Alzheimer's disease; taking the edge off with cannabinoids? |author=Campbell VA, Gowran A}}</ref> |
|||
===Psykososial intervensjon=== |
|||
[[File:Snoezelruimte.JPG|thumb|upright|righ|Et spesielt utformet rom for sensorisk integreringsterapi, også kalt snoezelen, en følelsesorientert psykososial intervensjon for personer med demens.]] |
|||
Psykososiale tiltak brukes som et supplement til medikamentell behandling og kan klassifiseres innenfor atferds-, følelses-, kognisjons- eller stimulerings-orienterte tilnærminger. Forskning på effekt er utilgjengelig og sjelden spesifikk for Alzheimers, men fokuserer i stedet på demens generelt. <ref name="pracGuideAPA">{{cite web |
|||
| url=http://www.psychiatryonline.com/pracGuide/loadGuidelinePdf.aspx?file=AlzPG101007 |
|||
| format=PDF |
|||
| title =Practice Guideline for the Treatment of Patients with Alzheimer's disease and Other Dementias |
|||
| publisher =[[American Psychiatric Association]] |
|||
| month=October | year=2007 |
|||
| accessdate=2007-12-28 |
|||
| doi=10.1176/appi.books.9780890423967.152139 |
|||
}}</ref> |
|||
Atferdsmessige tiltak forsøker å identifisere og redusere forutgående hendelser og konsekvenser av problematferd. Denne tilnærmingen har ikke vist suksess i å forbedre samlet fungering, <ref name="pmid16323385">{{cite journal |
|||
|author=Bottino CM, Carvalho IA, Alvarez AM, ''et al.'' |
|||
|title=Cognitive rehabilitation combined with drug treatment in Alzheimer's disease patients: a pilot study |
|||
|journal=Clin Rehabil |
|||
|volume=19 |
|||
|issue=8 |
|||
|pages=861–869 |
|||
|year=2005 |
|||
|pmid=16323385 |
|||
|doi=10.1191/0269215505cr911oa |
|||
}}</ref> |
|||
men kan bidra til å redusere en spesifikk problematferd, for eksempel inkontinens. <ref name="pmid11342679">{{cite journal |
|||
|author=Doody RS, Stevens JC, Beck C, ''et al.'' |
|||
|title=Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology |
|||
|journal=Neurology |
|||
|volume=56 |
|||
|issue=9 |
|||
|pages=1154–1166 |
|||
|year=2001 |
|||
|pmid=11342679 |
|||
}}</ref> Det er mangel på data av høy kvalitet på effektiviteten av disse teknikkene for andre atferdsproblemer som vandring. <ref name="pmid17253573">{{cite journal |
|||
|author=Hermans DG, Htay UH, McShane R |
|||
|title=Non-pharmacological interventions for wandering of people with dementia in the domestic setting |
|||
|journal=Cochrane Database Syst Rev |
|||
|issue=1 |
|||
|pages=CD005994 |
|||
|year=2007 |
|||
|pmid=17253573 |
|||
|doi=10.1002/14651858.CD005994.pub2 |
|||
}}</ref> <ref name="pmid17096455">{{cite journal |
|||
|author=Robinson L, Hutchings D, Dickinson HO, ''et al.'' |
|||
|title=Effectiveness and acceptability of non-pharmacological interventions to reduce wandering in dementia: a systematic review |
|||
|journal=Int J Geriatr Psychiatry |
|||
|volume=22 |
|||
|issue=1 |
|||
|pages=9–22 |
|||
|year=2007 |
|||
|pmid=17096455 |
|||
|doi=10.1002/gps.1643 |
|||
}}</ref> |
|||
Emosjonsorienterte tiltak omfatter erindringsterapi, valideringsterapi, støttende [[Psykoterapi|psykoterapi]], sensorisk integrasjon også kalt snoezelen og simulert tilstedeværelsesterapi. Støttende psykoterapi har vært gjenstand få eller ingen formelle vitenskapelige studier, men noen leger finner det nyttig i å hjelpe mildt rammede pasienter med å tilpasse seg sykdommen. <ref name="pracGuideAPA"></ref> Erindringsterapi (RT) innebærer drøfting av tidligere erfaringer individuelt eller i gruppe, mange ganger med hjelp av fotografier, husholdningsartikler, musikk og lydopptak, eller andre kjente elementer fra fortiden. Selv om det er få kvalitetsstudier på effekten av RT, kan det være fordelaktig for [[Kognisjon|kognisjon]] og [[Humør|humør]]. <ref name="pmid15846613">{{cite journal |
|||
|author=Woods B, Spector A, Jones C, Orrell M, Davies S |
|||
|title=Reminiscence therapy for dementia |
|||
|journal=Cochrane Database Syst Rev |
|||
|issue=2 |
|||
|pages=CD001120 |
|||
|year=2005 |
|||
|pmid=15846613 |
|||
|doi=10.1002/14651858.CD001120.pub2 |
|||
}}</ref> |
|||
Simulert tilstedeværelsesterapi (SPT) er basert på tilknytningsteorier og innebærer å spille av en innspilling med stemmene til de nærmeste slektningene for pasienten. Det finnes delvis dokumentasjon som tyder på at SPT kan redusere utfordrende atferd. <ref name="pmid19023729">{{cite journal |
|||
|author=Zetteler J |
|||
|title=Effectiveness of simulated presence therapy for individuals with dementia: a systematic review and meta-analysis |
|||
|journal=Aging Ment Health |
|||
|volume=12 |
|||
|issue=6 |
|||
|pages=779–85 |
|||
|year=2008 |
|||
|month=November |
|||
|pmid=19023729 |
|||
|doi=10.1080/13607860802380631 |
|||
}}</ref> |
|||
Valideringsterapi er basert på aksept av virkeligheten og personlig sannhet av en annens opplevelse, mens sensorisk integrasjon er basert på øvelser som har som mål å stimulere til sansene. Det er lite dokumentasjon som støtter nytten av disse terapiene. <ref name="pmid12917907">{{cite journal |
|||
|author=Neal M, Briggs M |
|||
|title=Validation therapy for dementia |
|||
|journal=Cochrane Database Syst Rev |
|||
|issue=3 |
|||
|pages=CD001394 |
|||
|year=2003 |
|||
|pmid=12917907 |
|||
|doi=10.1002/14651858.CD001394 |
|||
}}</ref> <ref name="pmid12519587">{{cite journal |
|||
|author=Chung JC, Lai CK, Chung PM, French HP |
|||
|title=Snoezelen for dementia |
|||
|journal=Cochrane Database Syst Rev |
|||
|issue=4 |
|||
|pages=CD003152 |
|||
|year=2002 |
|||
|pmid=12519587 |
|||
|doi=10.1002/14651858.CD003152 |
|||
}}</ref> |
|||
Målet med kognisjons-orienterte behandlinger, som inkluderer virkelighetsorientering og kognitiv gjenlæring, er reduksjon av kognitiv svekkelse. Virkelighetsorientering består i presentasjon av informasjon om tid, sted eller person for å lette pasientens forståelse av sine omgivelser og sin plass i disse. Kognitiv gjenlæring prøver å forbedre nedsatt kapasitet ved øving av mentale evner. Begge har vist noe effekt i å bedre kognitiv kapasitet, <ref name="pmid17636652">{{cite journal |
|||
|author=Spector A, Orrell M, Davies S, Woods B |
|||
|title=Withdrawn: Reality orientation for dementia |
|||
|journal=Cochrane Database Syst Rev |
|||
|issue=3 |
|||
|pages=CD001119 |
|||
|year=2000 |
|||
|pmid=17636652 |
|||
|doi=10.1002/14651858.CD001119.pub2 |
|||
}}</ref> <ref name="pmid12948999">{{cite journal |
|||
|author=Spector A, Thorgrimsen L, Woods B, ''et al.'' |
|||
|title=Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia: randomised controlled trial |
|||
|journal=Br J Psychiatry |
|||
|volume=183 |
|||
|pages=248–254 |
|||
|year=2003 |
|||
|pmid=12948999 |
|||
|doi=10.1192/bjp.183.3.248 |
|||
}}</ref> men i enkelte studier var disse effektene forbigående, og negative effekter, som frustrasjon, har også blitt rapportert. <ref name="pracGuideAPA"></ref> |
|||
Stimuleringsorienterte behandlinger inkluderer kunst, [[Musikkterapi|musikk]] og [[Dyreassistert terapi|kjæledyr]]terapi, [[Fysioterapi|mosjon]] og alle andre typer fritidsaktiviteter. Stimulering har beskjeden vitenskapelig støtte for å bedre atferd, humør, og, i mindre grad, funksjon. Selv om disse effektene er viktige, er den viktigste støtten for bruk av stimuleringsterapi endringen i pasientens rutine. <ref name="pracGuideAPA"></ref> |
|||
===Omsorg=== |
|||
{{Further|[[Caregiving and dementia]]}} |
|||
Siden Alzheimers ikke har noen kur, og den gradvis gjør folk ute av stand til å klare seg selv, er omsorg den viktigste behandlingen, og den må håndteres nøye gjennom hele forløpet av sykdommen. |
|||
I de tidlige og moderate stadiene vil tilpasninger av bomiljø og livsstil kunne øke pasientsikkerheten og redusere belastningen på omsorgspersonene. <ref name="pmid11220813">{{cite journal |
|||
|author = Gitlin LN, Corcoran M, Winter L, Boyce A, Hauck WW |
|||
|title = A randomized, controlled trial of a home environmental intervention: effect on efficacy and upset in caregivers and on daily function of persons with dementia |
|||
|journal = Gerontologist |
|||
|volume = 41 |
|||
|issue = 1 |
|||
|pages = 4–14 |
|||
|date = 1 February 2001 |
|||
|pmid = 11220813 |
|||
|url = http://gerontologist.gerontologyjournals.org/cgi/pmidlookup?view=long&pmid=11220813 |
|||
|accessdate=2008-07-15 |
|||
}}</ref> <ref name="pmid15860476">{{cite journal |
|||
|author=Gitlin LN, Hauck WW, Dennis MP, Winter L |
|||
|title=Maintenance of effects of the home environmental skill-building program for family caregivers and individuals with Alzheimer's disease and related disorders |
|||
|journal=J. Gerontol. A Biol. Sci. Med. Sci. |
|||
|volume=60 |
|||
|issue=3 |
|||
|pages=368–74 |
|||
|year=2005 |
|||
|month=March |
|||
|pmid=15860476 |
|||
}}</ref> Eksempler på slike tilpasninger er etterlevelse av forenklede rutiner, plassering av sikkerhetslåser, merking av husholdninggjenstander for å hjelpe pasienten med bruk av dagligdagse gjenstander. <ref name="pracGuideAPA"></ref> <ref> |
|||
{{cite web |
|||
|url=http://web.archive.org/web/20060925112503/http://www.alz.org/Health/Treating/agitation.asp |
|||
|title= Treating behavioral and psychiatric symptoms |
|||
|year=2006 |
|||
|accessdate=2006-09-25 |
|||
|publisher = Alzheimer's Association |
|||
}}</ref> <ref name="pmid15297089"> |
|||
{{cite journal |
|||
| author = Dunne TE, Neargarder SA, Cipolloni PB, Cronin-Golomb A |
|||
| title = Visual contrast enhances food and liquid intake in advanced Alzheimer's disease |
|||
| journal = Clinical Nutrition |
|||
| volume = 23 |
|||
| issue = 4 |
|||
| pages = 533–538 |
|||
| year = 2004 |
|||
| pmid = 15297089 |
|||
| doi = 10.1016/j.clnu.2003.09.015 |
|||
}}</ref> Pasientene kan også bli ute av stand til å mate seg selv, så de trenger å få maten i mindre biter eller most. <ref>{{cite book |
|||
|author=Dudek, Susan G. |
|||
|title=Nutrition essentials for nursing practice |
|||
|publisher=Lippincott Williams & Wilkins |
|||
|location=Hagerstown, Maryland |
|||
|year=2007 |
|||
|page=360 |
|||
|isbn=0-7817-6651-6 |
|||
|oclc= |
|||
|doi= |
|||
|url= http://books.google.com/?id=01zo6yf0IUEC&pg=PA360&dq=alzheimer%27s+chew |
|||
|accessdate=2008-08-19 |
|||
}}</ref> Når svelgevansker oppstår, kan bruk av materør være nødvendig. I slike tilfeller er medisinsk effekt og etikk i forhold til fortsatt mating en viktig vurdering for omsorgspersoner og familiemedlemmer. <ref name="pmid16415742">{{cite journal |
|||
|author=Dennehy C |
|||
|title=Analysis of patients' rights: dementia and PEG insertion |
|||
|journal=Br J Nurs |
|||
|volume=15 |
|||
|issue=1 |
|||
|pages=18–20 |
|||
|year=2006 |
|||
|pmid=16415742 |
|||
}}</ref> <ref name="pmid16556924">{{cite journal |
|||
|author=Chernoff R |
|||
|title=Tube feeding patients with dementia |
|||
|journal=Nutr Clin Pract |
|||
|volume=21 |
|||
|issue=2 |
|||
|pages=142–6 |
|||
|year=2006 |
|||
|month=April |
|||
|pmid=16556924 |
|||
|doi=10.1177/0115426506021002142 |
|||
}}</ref> Bruk av fysisk tvang er sjelden indisert i noe stadium av sykdommen, selv om det er situasjoner når det er nødvendig for å hindre skade på pasientene eller deres omsorgspersoner. <ref name="pracGuideAPA"></ref> |
|||
Etter hvert som sykdommen utvikler seg, kan forskjellige medisinske problemer vise seg, slik som sykdommer i munnhulen og tannsykdomer, [[Trykksår|trykksår]], [[Underernæring|feilernæring]], [[Hygiene|hygiene]]problemer eller [[Åndedrettssystemet|luftveis]]- [[Hud|hud]]- eller [[Øye|øye]][[Infeksjon|infeksjon]]er. Oppmerksom pleie kan forhindre disse, mens profesjonell behandling er nødvendig når de oppstår. <ref name="pmid10369823">{{cite journal |
|||
|author=Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R |
|||
|title=Predictors of mortality in patients with Alzheimer's disease living in nursing homes |
|||
|journal=J. Neurol. Neurosurg. Psychiatr. |
|||
|volume=67 |
|||
|issue=1 |
|||
|pages=59–65 |
|||
|year=1999 |
|||
|month=July |
|||
|pmid=10369823 |
|||
|pmc=1736445 |
|||
|doi=10.1136/jnnp.67.1.59 |
|||
}}</ref> <ref> Medisinsk spørsmål: |
|||
*{{cite journal |
|||
|author=Head B |
|||
|title=Palliative care for persons with dementia |
|||
|journal=Home Healthc Nurse |
|||
|volume=21 |
|||
|issue=1 |
|||
|pages=53–60; quiz 61 |
|||
|year=2003 |
|||
|month=January |
|||
|pmid=12544465 |
|||
|doi=10.1097/00004045-200301000-00012 |
|||
}} |
|||
*{{cite journal |
|||
|author=Friedlander AH, Norman DC, Mahler ME, Norman KM, Yagiela JA |
|||
|title=Alzheimer's disease: psychopathology, medical management and dental implications |
|||
|journal=J Am Dent Assoc |
|||
|volume=137 |
|||
|issue=9 |
|||
|pages=1240–51 |
|||
|year=2006 |
|||
|month=September |
|||
|pmid=16946428 |
|||
}} |
|||
*{{cite journal |
|||
|author=Belmin J |
|||
|title=Practical guidelines for the diagnosis and management of weight loss in Alzheimer's disease: a consensus from appropriateness ratings of a large expert panel |
|||
|journal=J Nutr Health Aging |
|||
|volume=11 |
|||
|issue=1 |
|||
|pages=33–7 |
|||
|year=2007 |
|||
|pmid=17315078 |
|||
|author2=Expert Panel and Organisation Committee |
|||
}} |
|||
*{{cite journal |
|||
|author=McCurry SM, Gibbons LE, Logsdon RG, Vitiello M, Teri L |
|||
|title=Training caregivers to change the sleep hygiene practices of patients with dementia: the NITE-AD project |
|||
|journal=J Am Geriatr Soc |
|||
|volume=51 |
|||
|issue=10 |
|||
|pages=1455–60 |
|||
|year=2003 |
|||
|month=October |
|||
|pmid=14511168 |
|||
|doi=10.1046/j.1532-5415.2003.51466.x |
|||
}} |
|||
*{{cite journal |
|||
|author=Perls TT, Herget M |
|||
|title=Higher respiratory infection rates on an Alzheimer's special care unit and successful intervention |
|||
|journal=J Am Geriatr Soc |
|||
|volume=43 |
|||
|issue=12 |
|||
|pages=1341–4 |
|||
|year=1995 |
|||
|month=December |
|||
|pmid=7490383 |
|||
}} </ ref> I de siste fasene av sykdommen er behandlingen sentrert om å lindre ubehag frem til døden. <ref name="pmid12854952">{{cite journal |
|||
|author=Shega JW, Levin A, Hougham GW, ''et al.'' |
|||
|title=Palliative Excellence in Alzheimer Care Efforts (PEACE): a program description |
|||
|journal=J Palliat Med |
|||
|volume=6 |
|||
|issue=2 |
|||
|pages=315–20 |
|||
|year=2003 |
|||
|month=April |
|||
|pmid=12854952 |
|||
|doi=10.1089/109662103764978641 |
|||
}}</ref> |
|||
En liten fersk studie fra USA konkluderte med at pasienter med omsorgspersoner som hadde en realistisk forståelse av prognose og kliniske komplikasjoner ved sen demens, hadde mindre sannsynlighet for å få aggressiv behandling nær slutten av livet. |
|||
<ref>{{cite journal |
|||
|author=Mitchell SL, Teno JM, Kiely DK, ''et al.'' |
|||
|title=The clinical course of advanced dementia |
|||
|journal=N Engl J Med |
|||
|volume=361 |
|||
|issue=16 |
|||
|pages=1529–38 |
|||
|year=2009 |
|||
|month=Oct |
|||
|pmid=19828530 |
|||
|doi=10.1056/NEJMoa0902234 |
|||
|pmc=2778850}}</ref> |
|||
==Prognose== |
|||
[[File:Alzheimer and other dementias world map - DALY - WHO2004.svg|thumb|Uførhetsjusterte leveår for Alzheimer og andre demenssykdommer per 100.000 innbyggere i 2004. [452] [453] [454] [455] [456] [457] [458] [459] [460] [461] [462] [ 463] [464]]] |
|||
De tidlige stadiene av Alzheimers sykdom er vanskelige å diagnostisere. En definitiv diagnose stilles vanligvis når kognitiv svekkelse hindrer utføring av daglige gjøremål, selv om personen fortsatt kan bo for seg selv. Symptomene vil utvikle seg fra milde kognitive problemer, for eksempel hukommelsestap, gjennom økende stadier av kognitive og ikke-kognitive forstyrrelser, og eliminerer til slutt enhver mulighet for selvstendig liv. <ref name="pmid10653284"></ref> |
|||
[[Forventa levealder|Forventet levealder]] hos folk med sykdommen er redusert. <ref name="pmid3776457"></ref> <ref name="pmid8757016">{{cite journal |
|||
|author=Bowen JD, Malter AD, Sheppard L, ''et al.'' |
|||
|title=Predictors of mortality in patients diagnosed with probable Alzheimer's disease |
|||
|journal=Neurology |
|||
|volume=47 |
|||
|issue=2 |
|||
|pages=433–9 |
|||
|year=1996 |
|||
|month=August |
|||
|pmid=8757016 |
|||
}}</ref> <ref name="pmid12580712">{{cite journal |
|||
|author=Dodge HH, Shen C, Pandav R, DeKosky ST, Ganguli M |
|||
|title=Functional transitions and active life expectancy associated with Alzheimer disease |
|||
|journal=Arch. Neurol. |
|||
|volume=60 |
|||
|issue=2 |
|||
|pages=253–9 |
|||
|year=2003 |
|||
|month=February |
|||
|pmid=12580712 |
|||
|doi=10.1001/archneur.60.2.253 |
|||
}}</ref> Den gjennomsnittlige levealder etter diagnose er ca sju år. <ref name="pmid3776457"></ref> Færre enn 3 % av pasientene lever mer enn fjorten år. <ref name="pmid7793228"></ref> Sykdomstegn som har vært signifikant assosiert med redusert overlevelse, er økt alvorlighetsgrad av kognitiv svikt, nedsatt funksjonsnivå, fall og nevrologiske forstyrrelser. Andre sammenfallende sykdommer som [[Hjertesykdom|hjerteproblemer]], [[Diabetes mellitus|diabetes]] eller tidligere alkoholmisbruk er også assosiert med kortere overlevelse. <ref name="pmid8757016"></ref> <ref name="pmid15068977">{{cite journal |
|||
|author=Larson EB, Shadlen MF, Wang L, ''et al.'' |
|||
|title=Survival after initial diagnosis of Alzheimer disease |
|||
|journal=Ann. Intern. Med. |
|||
|volume=140 |
|||
|issue=7 |
|||
|pages=501–9 |
|||
|year=2004 |
|||
|month=April |
|||
|pmid=15068977 |
|||
}}</ref> <ref name="pmid7792352">{{cite journal |
|||
|author=Jagger C, Clarke M, Stone A |
|||
|title=Predictors of survival with Alzheimer's disease: a community-based study |
|||
|journal=Psychol Med |
|||
|volume=25 |
|||
|issue=1 |
|||
|pages=171–7 |
|||
|year=1995 |
|||
|month=January |
|||
|pmid=7792352 |
|||
|doi=10.1017/S0033291700028191 |
|||
}}</ref> Selv om lav alder ved debut gir høyere forventet antall års overlevelse, er den forventede levetid mye mer redusert i forhold til forventet levetid hos den friske befolkningen blant de yngre. <ref name="pmid12580712"></ref> Menn har en dårligere overlevelsesprognose enn kvinner. <ref name="pmid7793228"></ref> <ref name="pmid15883266">{{cite journal |
|||
|author=Ganguli M, Dodge HH, Shen C, Pandav RS, DeKosky ST |
|||
|title=Alzheimer disease and mortality: a 15-year epidemiological study |
|||
|journal=Arch. Neurol. |
|||
|volume=62 |
|||
|issue=5 |
|||
|pages=779–84 |
|||
|year=2005 |
|||
|month=May |
|||
|pmid=15883266 |
|||
|doi=10.1001/archneur.62.5.779 |
|||
}}</ref> |
|||
Sykdommen er den underliggende [[Død|dødsårsak]] i 70 % av alle tilfeller. <ref name="pmid3776457"></ref> [[Lungebetennelse|Lungebetennelse]] og [[Dehydrering|dehydrering]] er de hyppigste umiddelbare dødsårsaker, mens [[Kreft|kreft]] er en mindre hyppig dødsårsak enn i den generelle befolkningen. <ref name="pmid3776457"></ref> <ref name="pmid15883266"></ref> |
|||
==Epidemiologi== |
|||
{| Align = "left" border = "2" | class = "wikitable" style = "text-align: center" | + Insidensrater<br> etter fylte 65 år <ref name="pmid17727890"></ref> |
|||
| - |
|||
! Alder! Nye berørte<br> per tusen<br> person-år |
|||
| - |
|||
!65-69 |
|||
| 3 |
|||
| - |
|||
!70-74 |
|||
| 6 |
|||
| - |
|||
!75-79 |
|||
| 9 |
|||
| - |
|||
!80-84 |
|||
| 23 |
|||
| - |
|||
!85-89 |
|||
| 40 |
|||
| - |
|||
!90 - |
|||
| 69 |
|||
|} |
|||
To viktige mål brukes i [[Epidemiologi|epidemiologiske]] studier: insidens og prevalens. [[Insidens|Insidens]] er antall nye tilfeller per enhet av person-tid (vanligvis antall nye tilfeller per tusen person-år), mens [[Prevalens|prevalensen]] er det totale antall tilfeller av sykdommen i befolkningen til enhver tid. |
|||
Når det gjelder forekomst, gir kohort longitudinelle studier (studier hvor en sykdomsfri befolkning er fulgt opp gjennom årene) rater mellom 10 og 15 per tusen person-år for alle demens-sykdommer og 5-8 for Alzheimers, <ref name="pmid17727890">{{cite journal |
|||
|author=Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC |
|||
|title=Incidence and subtypes of dementia in three elderly populations of central Spain |
|||
|journal=J. Neurol. Sci. |
|||
|volume=264 |
|||
|issue=1–2 |
|||
|pages=63–72 |
|||
|year=2008 |
|||
|month=January |
|||
|pmid=17727890 |
|||
|doi=10.1016/j.jns.2007.07.021 |
|||
}}</ref> <ref name="pmid12028245">{{cite journal |
|||
|author=Di Carlo A, Baldereschi M, Amaducci L, ''et al.'' |
|||
|title=Incidence of dementia, Alzheimer's disease, and vascular dementia in Italy. The ILSA Study |
|||
|journal=J Am Geriatr Soc |
|||
|volume=50 |
|||
|issue=1 |
|||
|pages=41–8 |
|||
|year=2002 |
|||
|month=January |
|||
|pmid=12028245 |
|||
|doi=10.1046/j.1532-5415.2002.50006.x |
|||
|last12=Ilsa Working |
|||
|first12=Group |
|||
}}</ref> hvilket betyr at halvparten av nye demenstilfeller hvert år er Alzheimers. Høy alder er primær risikofaktor for sykdom og forekomst er ikke lik for alle aldre: hvert femte år etter fylte 65 år fordobles omtrent risikoen for å få sykdommen, og den øker fra 3 til så mye som 69 per tusen personår. <ref name="pmid17727890"></ref> <ref name="pmid12028245"></ref> Det er også kjønnsforskjeller i insidensen, kvinner har en høyere risiko for å utvikle Alzheimers, særlig i populasjonen eldre enn 85. <ref name="pmid12028245"></ref> <ref>{{cite journal |
|||
|author=Andersen K, Launer LJ, Dewey ME, ''et al.'' |
|||
|title=Gender differences in the incidence of AD and vascular dementia: The EURODEM Studies. EURODEM Incidence Research Group |
|||
|journal=Neurology |
|||
|volume=53 |
|||
|issue=9 |
|||
|pages=1992–7 |
|||
|year=1999 |
|||
|month=December |
|||
|pmid=10599770 |
|||
|last12=Martinez-Lage |
|||
|first12=JM |
|||
|last13=Stijnen |
|||
|first13=T |
|||
|last14=Hofman |
|||
|first14=A |
|||
}}</ref> |
|||
Utbredelse av Alzheimers i populasjoner er avhengig av ulike faktorer, inkludert forekomst og overlevelse. Siden forekomst av Alzheimers øker med alderen, er det spesielt viktig å inkludere gjennomsnittsalderen i befolkningen. I USA ble Alzheimer-prevalensen anslått til 1,6 % i 2000 både totalt og i aldersgruppen 65-74, og prevalensen økte til 19 % i 75-84 gruppen og 42 % gruppen over 84. <ref>2000 U.S. estimates: |
|||
*{{cite journal |
|||
|author=Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA |
|||
|title=Alzheimer disease in the US population: prevalence estimates using the 2000 census |
|||
|journal=Arch. Neurol. |
|||
|volume=60 |
|||
|issue=8 |
|||
|pages=1119–22 |
|||
|year=2003 |
|||
|month=August |
|||
|pmid=12925369 |
|||
|doi=10.1001/archneur.60.8.1119 |
|||
}} |
|||
*{{cite web |
|||
|title=Profiles of general demographic characteristics, 2000 census of population and housing, United States |
|||
|year=2001 |
|||
|publisher=U.S. Census Bureau |
|||
|url=http://www.census.gov/prod/cen2000/dp1/2kh00.pdf |
|||
|format=PDF |
|||
|accessdate=2008-08-27 |
|||
}} </ ref> Prevalensen i mindre utviklede regioner er lavere. {{Dead link|date=February 2010}} <ref name="pmid16360788"></ref> [[Verdens helseorganisasjon|Verdens helseorganisasjon]] anslår at i 2005 hadde 0,379 % av mennesker over hele verden demens, og at forekomsten vil øke til 0,441 % i 2015 og til 0.556 % i 2030. <ref name="isbn9789241563369">{{cite book |
|||
| last = World Health Organization |
|||
| title = Neurological Disorders: Public Health Challenges |
|||
| publisher = World Health Organization |
|||
| year = 2006 |
|||
| location = Switzerland |
|||
| pages = 204–207 |
|||
| url = http://www.who.int/mental_health/neurology/neurodiso/en/index.html |
|||
| isbn = 978-92-4-156336-9 }}</ref> Andre studier har kommet til lignende konklusjoner. <ref name="pmid16360788">{{cite journal |
|||
|author=Ferri CP, Prince M, Brayne C, ''et al.'' |
|||
|title=Global prevalence of dementia: a Delphi consensus study |
|||
|journal=Lancet |
|||
|volume=366 |
|||
|issue=9503 |
|||
|pages=2112–7 |
|||
|year=2005 |
|||
|month=December |
|||
|pmid=16360788 |
|||
|pmc=2850264 |
|||
|doi=10.1016/S0140-6736(05)67889-0 |
|||
|url=http://web.archive.org/web/20080625071754/http://www.sbgg.org.br/profissional/artigos/pdf/demencia_mundo.pdf |
|||
|accessdate=2008-06-25 |
|||
|format=PDF |
|||
|last12=Mathers |
|||
|first12=C |
|||
|last13=Menezes |
|||
|first13=PR |
|||
|last14=Rimmer |
|||
|first14=E |
|||
|last15=Scazufca |
|||
|first15=M |
|||
|last16=Alzheimer's Disease |
|||
|first16=International}}</ref> En annen studie beregnet at i 2006 var 0,40 % av verdens befolkning (område 0,17-0,89 %; absolutte tall {{Nowrap|26.6 million}} {{Nowrap|11.4–59.4 million}} ) rammet av Alzheimers, og at prevalens ville tredobles, og det absolutte antallet ville firedobles i løpet av 2050. <ref name="Brookmeyer2007"> 2006 prevalensestimat: |
|||
*{{cite journal |
|||
|author=Brookmeyer R, Johnson E, Ziegler-Graham K, MH Arrighi |
|||
|title=Forecasting the global burden of Alzheimer's disease |
|||
|journal=Alzheimer's and Dementia |
|||
|volume=3 |
|||
|issue=3 |
|||
|pages=186–91 |
|||
|year=2007 |
|||
|month=July |
|||
|doi=10.1016/j.jalz.2007.04.381 |
|||
|url=http://works.bepress.com/cgi/viewcontent.cgi?article=1022&context=rbrookmeyer |
|||
|accessdate=2008-06-18 |
|||
|pmid=19595937 |
|||
|last1=Brookmeyer |
|||
|first1=R |
|||
|last2=Johnson |
|||
|first2=E |
|||
|last3=Ziegler-Graham |
|||
|first3=K |
|||
|last4=Arrighi |
|||
|first4=HM |
|||
}} |
|||
*{{cite paper |
|||
|url=http://un.org/esa/population/publications/wpp2006/WPP2006_Highlights_rev.pdf |
|||
|format=PDF |
|||
|accessdate=2008-08-27 |
|||
|year=2007 |
|||
|title=World population prospects: the 2006 revision, highlights |
|||
|publisher=Population Division, Department of Economic and Social Affairs, United Nations |
|||
|version=Working Paper No. ESA/P/WP.202 |
|||
}} </ ref> |
|||
==Historikk== |
|||
[[File:Auguste D aus Marktbreit.jpg|thumb|Alois Alzheimers pasient Auguste Deter i 1902. Hennes var det første beskrevne tilfellet av det som ble kjent som Alzheimers sykdom.]] |
|||
De [[Antikken|gamle greske og romerske]] filosofene og [[Lege|lege]]ne forbandt alderdom med økende [[Demens|demens]]. <ref name="pmid9661992">{{cite journal |
|||
|author=Berchtold NC, Cotman CW |
|||
|title=Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s |
|||
|journal=Neurobiol. Aging |
|||
|volume=19 |
|||
|issue=3 |
|||
|pages=173–89 |
|||
|year=1998 |
|||
|pmid=9661992 |
|||
|doi=10.1016/S0197-4580(98)00052-9 |
|||
}}</ref> Det var ikke før 1901 at den tyske [[Psykiatri|psykiater]]en [[Alois Alzheimer|Alois Alzheimer]] oppdaget det første tilfellet av det som ble kjent som Alzheimers sykdom hos en femti år gammel kvinne som han kalte Auguste D. Alzheimer fulgte henne helt til hun døde i 1906, da han først rapporterte tilfellet offentlig. <ref> Auguste D.: |
|||
* {{ |
|||
cite journal |
|||
| author=Alzheimer Alois |
|||
| title=Über eine eigenartige Erkrankung der Hirnrinde [About a peculiar disease of the cerebral cortex] |
|||
| journal=Allgemeine Zeitschrift fur Psychiatrie und Psychisch-Gerichtlich Medizin |
|||
| volume=64 |
|||
| issue=1–2 |
|||
| pages=146–148 |
|||
| year=1907 |
|||
| language={{de icon}} |
|||
}} |
|||
*{{cite journal |
|||
|author=Alzheimer Alois |
|||
|title=About a peculiar disease of the cerebral cortex. By Alois Alzheimer, 1907 (Translated by L. Jarvik and H. Greenson) |
|||
|journal=Alzheimer Dis Assoc Disord |
|||
|volume=1 |
|||
|issue=1 |
|||
|pages=3–8 |
|||
|year=1987 |
|||
|pmid=3331112 |
|||
}} |
|||
*{{cite book |
|||
|author=Maurer Ulrike, Maurer Konrad |
|||
|title=Alzheimer: the life of a physician and the career of a disease |
|||
|publisher=Columbia University Press |
|||
|location=New York |
|||
|year=2003 |
|||
|page=270 |
|||
|isbn=0-231-11896-1 |
|||
|oclc= |
|||
}} </ ref> I løpet av de neste fem årene ble elleve lignende saker rapportert i medisinsk litteratur, noen av dem brukte allerede betegnelsen Alzheimers sykdom. <ref name="pmid9661992">{{cite journal |
|||
|author=Berchtold NC, Cotman CW |
|||
|title=Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s |
|||
|journal=Neurobiology of Aging |
|||
|volume=19 |
|||
|issue=3 |
|||
|pages=173–189 |
|||
|year=1998 |
|||
|pmid=9661992 |
|||
|doi=10.1016/S0197-4580(98)00052-9 |
|||
}}</ref> Sykdommen ble først beskrevet som en særegen sykdom av Emil Kraepelin etter å ha undertrykket noen av de kliniske (vrangforestillinger og hallusinasjoner) og patologiske funnene (arteriosklerotiske endringer) som finnes i den opprinnelige rapporten om Auguste D. <ref>{{cite journal |
|||
|author=Berrios G E |
|||
|title=Alzheimer's disease: a conceptual history |
|||
|journal=Int. J. Ger. Psychiatry |
|||
|volume=5 |
|||
|issue= |
|||
|pages=355–365 |
|||
|year=1990 |
|||
|month= |
|||
|pmid= |
|||
|doi=10.1002/gps.930050603 |
|||
}}</ref> Han inkluderte ''Alzheimers sykdom'' , også kalt ''presenil'' [[Demens|demens]] av Kraepelin, som en subtype av ''senil demens'' i den åttende utgaven av hans ''Textbook of Psychiatry'' , utgitt i 1910. <ref name="isbn1-4325-0833-4">{{cite book |
|||
|author=Kraepelin Emil, Diefendorf A. Ross (translated by) |
|||
|title=Clinical Psychiatry: A Textbook For Students And Physicians (Reprint) |
|||
|publisher=Kessinger Publishing |
|||
|date=2007-01-17 |
|||
|page=568 |
|||
|isbn=1-4325-0833-4 |
|||
|oclc= |
|||
}}</ref> |
|||
I mesteparten av det 20. århundre var diagnostisering av Alzheimers sykdom reservert for personer mellom 45 og 65 år som hadde utviklet symptomer på demens. Terminologien ble endret etter 1977 da en konferanse om Alzheimers konkluderte med at de kliniske og patologiske manifestasjoner av presenil og senil demens var nesten identiske, selv om forfatterne også la til at dette ikke utelukker muligheten for at de hadde ulike årsaker. <ref name="isbn0-89004-225-X">{{cite book |
|||
|author=Katzman Robert, Terry Robert D, Bick Katherine L (editors) |
|||
|title=Alzheimer's disease: senile dementia and related disorders |
|||
|publisher=Raven Press |
|||
|location=New York |
|||
|year=1978 |
|||
|page=595 |
|||
|isbn=0-89004-225-X |
|||
|oclc= |
|||
}}</ref> Dette førte til slutt til diagnostisering av ''Alzheimers sykdom'' uavhengig av alder. <ref name="pmid9702682">{{cite journal |
|||
|author=Boller F, Forbes MM |
|||
|title=History of dementia and dementia in history: an overview |
|||
|journal=J. Neurol. Sci. |
|||
|volume=158 |
|||
|issue=2 |
|||
|pages=125–33 |
|||
|year=1998 |
|||
|month=June |
|||
|pmid=9702682 |
|||
|doi=10.1016/S0022-510X(98)00128-2 |
|||
}}</ref> Begrepet ''senil demens av Alzheimers type'' (SDAT) ble brukt en stund for å beskrive tilstanden hos dem over 65, mens klassisk Alzheimers sykdom ble brukt for de yngre. Begrepet Alzheimers sykdom ble til slutt formelt vedtatt i medisinsk nomenklatur for å beskrive personer i alle aldre med et karakteristisk vanlig symptommønster, sykdomsforløp og nevropatologi. <ref name="pmid3531918">{{cite journal |
|||
|author=Amaducci LA, Rocca WA, Schoenberg BS |
|||
|title=Origin of the distinction between Alzheimer's disease and senile dementia: how history can clarify nosology |
|||
|journal=Neurology |
|||
|volume=36 |
|||
|issue=11 |
|||
|pages=1497–9 |
|||
|year=1986 |
|||
|month=November |
|||
|pmid=3531918 |
|||
}}</ref> |
|||
==Samfunn og kultur== |
|||
===Sosiale kostnader=== |
|||
Demens, og spesielt Alzheimers sykdom, kan være blant de mest kostbare sykdommene for samfunnet i Europa og USA.<ref name="pmid15685097"></ref> <ref name="pmid9543467"></ref> Kostnadene i andre land som [[Argentina|Argentina]] <ref name="pmid16870037">{{cite journal |
|||
|author=Allegri RF, Butman J, Arizaga RL, ''et al.'' |
|||
|title=Economic impact of dementia in developing countries: an evaluation of costs of Alzheimer-type dementia in Argentina |
|||
|journal=Int Psychogeriatr |
|||
|volume=19 |
|||
|issue=4 |
|||
|pages=705–18 |
|||
|year=2007 |
|||
|month=August |
|||
|pmid=16870037 |
|||
|doi=10.1017/S1041610206003784 |
|||
}}</ref> eller [[Sør-Korea|Sør-Korea]] <ref name="pmid16858741">{{cite journal |
|||
|author=Suh GH, Knapp M, Kang CJ |
|||
|title=The economic costs of dementia in Korea, 2002 |
|||
|journal=Int J Geriatr Psychiatry |
|||
|volume=21 |
|||
|issue=8 |
|||
|pages=722–8 |
|||
|year=2006 |
|||
|month=August |
|||
|pmid=16858741 |
|||
|doi=10.1002/gps.1552 |
|||
}}</ref> er også høy og stigende. Disse kostnadene vil trolig øke med aldringen av befolkningen, og bli et viktig samfunnsproblem. Alzheimers-relaterte kostnader omfatter direkte helseutgifter som for eksempel [[Sykepleie|sykehjem]]s[[Hjemmesykepleie|omsorg]] og hjemmesykepleie, men også indirekte kostnader som for eksempel tapt produktivitet for både pasient og personell. <ref name="pmid9543467"></ref> Tallene varierer mellom studier, men demens-kostnader over hele verden er beregnet til rundt 160 milliarder dollar, <ref name="pmid16401889">{{cite journal |
|||
|author=Wimo A, Jonsson L, Winblad B |
|||
|title=An estimate of the worldwide prevalence and direct costs of dementia in 2003 |
|||
|journal=Dement Geriatr Cogn Disord |
|||
|volume=21 |
|||
|issue=3 |
|||
|pages=175–81 |
|||
|year=2006 |
|||
|pmid=16401889 |
|||
|doi=10.1159/000090733 |
|||
}}</ref> mens kostnadene for Alzheimer i USA kan bli 100 milliarder dollar hver år. <ref name="pmid9543467"></ref> |
|||
De største kostnadene for samfunnet kommer fra langsiktig omsorg av helsepersonell, og spesielt institusjonalisering noe som tilsvarer 2 / 3 av de totale kostnadene for samfunnet. <ref name="pmid15685097"></ref> Kostnaden for hjemmeboende er også svært høy, <ref name="pmid15685097"></ref> spesielt når uformelle kostnader for familien, for eksempel pleietid og omsorgspersonens tapte arbeidsfortjeneste blir tatt hensyn til. <ref name="pmid11445614">{{cite journal |
|||
|author=Moore MJ, Zhu CW, Clipp EC |
|||
|title=Informal costs of dementia care: estimates from the National Longitudinal Caregiver Study |
|||
|journal=J Gerontol B Psychol Sci Soc Sci |
|||
|volume=56 |
|||
|issue=4 |
|||
|pages=S219–28 |
|||
|year=2001 |
|||
|month=July |
|||
|pmid=11445614 |
|||
}}</ref> |
|||
Kostnadene øker med alvorlighetsgrad av demens og tilstedeværelsen av adferdsforstyrrelser, <ref name="pmid16676288">{{cite journal |
|||
|author=Jönsson L, Eriksdotter Jönhagen M, Kilander L, ''et al.'' |
|||
|title=Determinants of costs of care for patients with Alzheimer's disease |
|||
|journal=Int J Geriatr Psychiatry |
|||
|volume=21 |
|||
|issue=5 |
|||
|pages=449–59 |
|||
|year=2006 |
|||
|month=May |
|||
|pmid=16676288 |
|||
|doi=10.1002/gps.1489 |
|||
}}</ref> og de er relatert til den økte omsorgstiden som kreves for å gi fysisk omsorg. <ref name="pmid11445614"></ref> Derfor vil enhver behandling som bremser kognitiv svikt, utsetter institusjonalisering eller reduserer omsorgspersonstimer, innebære økonomiske fordeler. Økonomiske evalueringer av nåværende behandlinger har vist positive resultater. <ref name="pmid9543467"></ref> |
|||
===Omsorgsbyrde=== |
|||
{{Further|[[Caregiving and dementia]]}} |
|||
Rollen som viktigste omsorgsperson blir ofte tatt av ektefelle eller en nær slektning. {{Dead link|date=February 2010}} <ref name="metlife.com"></ref> Alzheimers sykdom er kjent for å plassere en stor belastning på omsorgspersonene som inkluderer sosiale, psykologiske, fysiske eller økonomiske forhold. <ref name="pmid17662119"></ref> <ref name="pmid10489656"></ref> <ref name="pmid10489657">{{cite journal |
|||
|author=Murray J, Schneider J, Banerjee S, Mann A |
|||
|title=EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II—A qualitative analysis of the experience of caregiving |
|||
|journal=Int J Geriatr Psychiatry |
|||
|volume=14 |
|||
|issue=8 |
|||
|pages=662–7 |
|||
|year=1999 |
|||
|month=August |
|||
|pmid=10489657 |
|||
|doi=10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4 |
|||
}}</ref> Hjemmetjenester er vanligvis foretrukket av pasienter og familier. <ref name="pmid18044111">{{cite journal |
|||
|author=Zhu CW, Sano M |
|||
|title=Economic considerations in the management of Alzheimer's disease |
|||
|journal=Clin Interv Aging |
|||
|volume=1 |
|||
|issue=2 |
|||
|pages=143–54 |
|||
|year=2006 |
|||
|pmid=18044111 |
|||
|doi=10.2147/ciia.2006.1.2.143 |
|||
|pmc=2695165 |
|||
}}</ref> Dette alternativet utsetter eller eliminerer også behovet for mer profesjonelle og kostbare nivåer av omsorg. <ref name="pmid18044111"></ref> <ref>{{cite journal |
|||
|author=Gaugler JE, Kane RL, Kane RA, Newcomer R |
|||
|title=Early community-based service utilization and its effects on institutionalization in dementia caregiving |
|||
|journal=Gerontologist |
|||
|volume=45 |
|||
|issue=2 |
|||
|pages=177–85 |
|||
|year=2005 |
|||
|month=April |
|||
|pmid=15799982 |
|||
}}</ref> Likevel har to tredjedeler av sykehjemsbeboere demens. <ref name="pracGuideAPA"></ref> |
|||
Demens-omsorgspersoner er utsatt for høy forekomst av fysiske og [[Psykisk lidelse|psykiske]] lidelser. <ref name="pmid12480441">{{cite journal |
|||
|author=Ritchie K, Lovestone S |
|||
|title=The dementias |
|||
|journal=Lancet |
|||
|volume=360 |
|||
|issue=9347 |
|||
|pages=1759–66 |
|||
|year=2002 |
|||
|month=November |
|||
|pmid=12480441 |
|||
|doi=10.1016/S0140-6736(02)11667-9 |
|||
}}</ref> Faktorer assosiert med større psykososiale problemer for primære omsorgspersoner inkluderer å ha en berørt person hjemme, at pleieren er en ektefelle, krevende atferd fra pasienten som depresjon, atferdsforstyrrelser, hallusinasjoner, søvnproblemer eller vandring og sosial isolasjon. <ref name="pmid2241719">{{cite journal |
|||
|author=Brodaty H, Hadzi-Pavlovic D |
|||
|title=Psychosocial effects on carers of living with persons with dementia |
|||
|journal=Aust N Z J Psychiatry |
|||
|volume=24 |
|||
|issue=3 |
|||
|pages=351–61 |
|||
|year=1990 |
|||
|month=September |
|||
|pmid=2241719 |
|||
|doi=10.3109/00048679009077702 |
|||
}}</ref> <ref name="pmid9646153">{{cite journal |
|||
|author=Donaldson C, Tarrier N, Burns A |
|||
|title=Determinants of carer stress in Alzheimer's disease |
|||
|journal=Int J Geriatr Psychiatry |
|||
|volume=13 |
|||
|issue=4 |
|||
|pages=248–56 |
|||
|year=1998 |
|||
|month=April |
|||
|pmid=9646153 |
|||
|doi=10.1002/(SICI)1099-1166(199804)13:4<248::AID-GPS770>3.0.CO;2-0 |
|||
}}</ref> Når det gjelder økonomiske problemer, tar omsorgspersoner i familien ofte fri fra jobben for å tilbringe i gjennomsnitt 47 timer per uke med Alzheimerspasienten, samtidig som at omsorgskostnadene er høye. Direkte og indirekte kostnader for omsorg for en Alzheimers-pasient er gjennomsnittlig mellom 18 000 dollar og 77 500 dollar per år i USA, avhengig av studien. <ref name="pmid11445614"></ref> {{Dead link|date=February 2010}} <ref>{{Dead link|date=February 2010}} |
|||
{{cite web |
|||
| title= The MetLife Study of Alzheimer's Disease: The Caregiving Experience |
|||
| month=August | year=2006 |
|||
| url=http://www.metlife.com/WPSAssets/14050063731156260663V1FAlzheimerCaregivingExperience.pdf |
|||
| publisher=MetLife Mature Market Institute |
|||
| format=PDF |
|||
| accessdate=2008-02-12 |
|||
}}</ref> |
|||
[[Kognitiv adferdsterapi|Kognitiv atferdsterapi]] og undervisning i mestringsstrategier, enten individuelt eller i gruppe, har vist effekt i å bedre omsorgspersoners psykiske helse. <ref name="pmid17662119"></ref> <ref name="pmid11511058">{{cite journal |
|||
|author=Pusey H, Richards D |
|||
|title=A systematic review of the effectiveness of psychosocial interventions for carers of people with dementia |
|||
|journal=Aging Ment Health |
|||
|volume=5 |
|||
|issue=2 |
|||
|pages=107–19 |
|||
|year=2001 |
|||
|month=May |
|||
|pmid=11511058 |
|||
|doi=10.1080/13607860120038302 |
|||
}}</ref> |
|||
===Kjente tilfeller=== |
|||
{{Further|[[Alzheimer's in the media]]}} |
|||
[[File:Ronald Reagan Charlton Heston.jpg|thumb|Charlton Heston og Ronald Reagan på et møte i Det hvite hus. Begge skulle senere utvikle Alzheimers sykdom.]] |
|||
Siden Alzheimers sykdom er svært utbredt, har mange kjente mennesker utviklet dette. Kjente eksempler er tidligere USAs president [[Ronald Reagan|Ronald Reagan]] og den irske forfatteren [[Iris Murdoch|Iris Murdoch]], som begge var gjenstand for vitenskapelige artikler som undersøkte hvordan deres kognitive kapasitet ble forverret med sykdommen. <ref name="pmid15574466">{{cite journal |
|||
|author=Garrard P, Maloney LM, Hodges JR, Patterson K |
|||
|title=[http://brain.oxfordjournals.org/cgi/content/full/128/2/250 The effects of very early Alzheimer's disease on the characteristics of writing by a renowned author] |
|||
|journal=Brain |
|||
|volume=128 |
|||
|issue=Pt 2 |
|||
|pages=250–60 |
|||
|year=2005 |
|||
|month=February |
|||
|pmid=15574466 |
|||
|doi=10.1093/brain/awh341 |
|||
}}</ref> <ref name="pmid15461232">{{cite journal |
|||
|author=Sherman FT |
|||
|title=[http://www.modernmedicine.com/modernmedicine/article/articleDetail.jsp?id=121676 Did President Reagan have mild cognitive impairment while in office? Living longer with Alzheimer's Disease] |
|||
|journal=Geriatrics |
|||
|volume=59 |
|||
|issue=9 |
|||
|pages=11, 15 |
|||
|year=2004 |
|||
|month=September |
|||
|pmid=15461232 |
|||
}}</ref> <ref name="pmid15788549">{{cite journal |
|||
|author=Venneri A, Forbes-Mckay KE, Shanks MF |
|||
|title=Impoverishment of spontaneous language and the prediction of Alzheimer's disease |
|||
|journal=Brain |
|||
|volume=128 |
|||
|issue=Pt 4 |
|||
|pages=E27 |
|||
|year=2005 |
|||
|month=April |
|||
|pmid=15788549 |
|||
|doi=10.1093/brain/awh419 |
|||
|url= |
|||
}}</ref> Andre tilfeller er <ref>{{cite news |
|||
| url=http://news.bbc.co.uk/sport1/hi/football/europe/6155766.stm |
|||
|title=Hungary legend Puskas dies at 79 |
|||
|publisher=BBC News |date=2006-11-17 |
|||
|accessdate=2008-01-25}} |
|||
</ref> tidligere statsminister [[Harold Wilson|Harold Wilson]] (Storbritannia) og Adolfo Suárez ([[Spania|Spania]]) <ref>{{cite web |
|||
|url=http://www.number10.gov.uk/history-and-tour/prime-ministers-in-history/harold-wilson |
|||
|title=Prime Ministers in History: Harold Wilson |
|||
|publisher=10 Downing Street |
|||
|location=London |
|||
|accessdate=2008-08-18 |
|||
}}</ref> <ref>{{cite web |
|||
|url=http://www.elpais.com/articulo/espana/padre/reconocio/Rey/noto/carino/elpepiesp/20080718elpepinac_11/Tes |
|||
|title=Mi padre no reconoció al Rey pero notó el cariño |
|||
|publisher=El País |
|||
|location=Madrid |
|||
|year=2008 |
|||
|accessdate=2008-10-01 |
|||
}}</ref> skuespillerinnen [[Rita Hayworth|Rita Hayworth]] <ref>{{cite web |
|||
|url=http://www.alz.org/galas/Rita/overview.asp |
|||
|title=Chicago Rita Hayworth Gala |
|||
|publisher=Alzheimer's Association |
|||
|year=2007 |
|||
|accessdate=2010-02-03 }} |
|||
</ref> skuespilleren [[Charlton Heston|Charlton Heston]] og <ref>{{cite web |
|||
|url=http://archives.cnn.com/2002/US/08/09/heston.illness/ |
|||
|title=Charlton Heston has Alzheimer's symptoms |
|||
|publisher=CNN |
|||
|date=2002-08-09 |
|||
|accessdate=2008-01-25}} |
|||
</ref> forfatteren [[Terry Pratchett|Terry Pratchett]].<ref>{{cite web |
|||
|url=http://www.straitstimes.com/Breaking%2BNews/Asia/Story/STIStory_439665.html |
|||
|title=Nobel Prize Winner has Alzheimer's |
|||
|publisher=The Straits Times |
|||
|date=2009-10-08 |
|||
|accessdate=2009-10-09 |
|||
}}</ref> |
|||
Alzheimers har også blitt portrettert i filmer som: ''Iris'' (2001), <ref>{{cite web |
|||
|url=http://www.imdb.com/title/tt0280778/ |
|||
|title=Iris |
|||
|date=2002-01-18 |publisher=IMDB |
|||
|accessdate=2008-01-24}}</ref> basert på John Bayleys biografi om hans kone [[Iris Murdoch|Iris Murdoch]] <ref>{{cite book |
|||
|title=Iris: a memoir of Iris Murdoch |
|||
|author=Bayley John |
|||
|publisher=Abacus |
|||
|location=London |
|||
|year=2000 |
|||
|isbn=9780349112152 |
|||
|oclc=41960006 }}</ref> |
|||
''The Notebook'' (2004), <ref>{{cite web |
|||
|url=http://www.imdb.com/title/tt0332280/ |
|||
|title=The notebook |publisher=IMDB |
|||
|accessdate=2008-02-22}}</ref> basert på Nicholas Sparks roman med samme navn, <ref>{{cite book |
|||
|title=The notebook |
|||
|author=Sparks Nicholas |
|||
|year=1996 |
|||
|publisher=Thorndike Press |
|||
|location=Thorndike, Maine |
|||
|page=268 |
|||
|isbn=078620821X }} |
|||
</ref> ''A Moment to Remember'' (2004); ''Thanmathra'' (2005), <ref>{{cite web |
|||
|url=http://www.webindia123.com/movie/regional/thanmatra/index.htm |
|||
|title=Thanmathra |
|||
|publisher=Webindia123.com |
|||
|accessdate=2008-01-24}} |
|||
</ref> ''Memories of Tomorrow (Ashita no Kioku)'' (2006 ), <ref>{{cite web |
|||
|url=http://www.imdb.com/title/tt0494640/ |
|||
|title=Ashita no kioku |
|||
|originallanguage={{jp icon}} |
|||
|publisher=IMDB |
|||
|accessdate=2008-01-24}}</ref> basert på Hiroshi Ogiwaras roman med samme navn, <ref>{{cite book |
|||
|author=Ogiwara Hiroshi |
|||
|year=2004 |
|||
|title=Ashita no Kioku |
|||
|location=Tōkyō |
|||
|publisher=Kōbunsha |
|||
|isbn=9784334924461 |
|||
|oclc=57352130 |
|||
|language={{jp icon}} |
|||
|isbn-status=May be invalid – please double check |
|||
}}</ref> ''[[Away from Her|Away from Her]]'' (2006), basert på [[Alice Munro|Alice Munro]]s [[Short story|novelle]], The Bear Came over the Mountain <ref>{{cite book |
|||
|title=[[Hateship, Friendship, Courtship, Loveship, Marriage|Hateship, Friendship, Courtship, Loveship, Marriage: Stories]] |
|||
|author=Munro Alice |
|||
|location=New York |
|||
|publisher=A.A. Knopf |
|||
|year=2001 |
|||
|isbn=9780375413001 |
|||
|oclc=46929223 |
|||
|chapter-url=The bear came over the mountain}}</ref> og den svenske filmen En sång för Martin. Dokumentarer om Alzheimers sykdom inkluderer ''Malcolm og Barbara: A Love Story'' (1999) og ''Malcolm og Barbaras:Love's Farewell'' (2007), begge med Malcolm Pointon. <ref> Malcolm and Barbara: |
|||
* {{cite web |
|||
|url=http://www.dfgdocs.com/Directory/Titles/700.aspx |
|||
|title=Malcolm and Barbara: A love story |
|||
|publisher=Dfgdocs |
|||
|accessdate=2008-01-24}} |
|||
* {{cite web |
|||
|url=http://www.bbc.co.uk/cambridgeshire/content/articles/2007/08/06/pointon_audio_feature.shtml |
|||
|title=Malcolm and Barbara: A love story |
|||
|publisher=BBC Cambridgeshire |
|||
|accessdate=2008-03-02}} |
|||
* {{cite news |
|||
|url=http://www.guardian.co.uk/media/2007/aug/07/broadcasting.itv |
|||
|title=Alzheimer's film-maker to face ITV lawyers |
|||
|publisher=Guardian Media |
|||
|date=2007-08-07 |
|||
|accessdate=2008-01-24 | location=London | first=John | last=Plunkett}} </ ref> |
|||
==Forskningsretninger== |
|||
{{Main|Alzheimer's disease clinical research}} |
|||
{{as of |
|||
| 2008}} , sikkerheten og effekten til mer enn 400 medikamenter blir undersøkt i klinisk utprøving over hele verden, og omtrent en fjerdedel av disse forbindelsene er i fase III-studier, det siste trinnet før de vurderes av tilsynsorganer. <ref>{{cite web |
|||
|url=http://www.clinicaltrials.gov/ct2/results?term=alzheimer |
|||
|title= Clinical Trials. Found 459 studies with search of: alzheimer |
|||
|accessdate= 2008-03-23 |
|||
|publisher= US National Institutes of Health |
|||
}}</ref> |
|||
Et område av klinisk forskning er fokusert på å behandle den underliggende sykdommens patologi. Reduksjon av amyloid beta-nivåer er et felles mål for forbindelser <ref> |
|||
{{cite journal |
|||
|author=Lashuel HA, Hartley DM, Balakhaneh D, Aggarwal A, Teichberg S, [[David J E Callaway|Callaway DJE]] |
|||
|title=New class of inhibitors of [[Beta amyloid|amyloid-beta]] fibril formation. Implications for the mechanism of pathogenesis in Alzheimer's disease |
|||
|url=http://www.jbc.org/cgi/content/abstract/277/45/42881 |
|||
|journal=[[Journal of Biological Chemistry|J Biol Chem]] |
|||
|year=2002 |
|||
|volume=277 |
|||
|pages=42881–42890 |
|||
|pmid=12167652 |
|||
|doi=10.1074/jbc.M206593200 |
|||
|issue=45 |
|||
}}</ref> (som for eksempel apomorfin) det forskes på. Immunterapi eller vaksinasjon mot amyloid-protein er en behandling som studeres. <ref> |
|||
{{cite journal |
|||
|author=Dodel r, Neff F, Noelker C, Pul R, Du Y, Bacher M Oertel W. |
|||
|title=Intravenous Immunoglobulins as a Treatment for Alzheimer's Disease: Rationale and Current Evidence |
|||
|url=http://adisonline.com/drugs/Abstract/2010/70050/Intravenous_Immunoglobulins_as_a_Treatment_for.1.aspx |
|||
|journal=Drugs |
|||
|year=2010 |
|||
|volume=70 |
|||
|pages=513–528 |
|||
|pmid=20329802 |
|||
|doi=10.2165/11533070-000000000-00000 |
|||
|issue=5 |
|||
}}</ref> I motsetning til forebyggende vaksinering, ville den antatte terapi brukes til å behandle folk som allerede er diagnostisert. Det er basert på konseptet om trening av [[Immunforsvar|immunsystemet]] til å gjenkjenne, angripe, og reversere deponering av amyloid, og dermed endre sykdomsforløpet. <ref>Vaccination: |
|||
* {{cite journal |
|||
|author=Hawkes CA, McLaurin J |
|||
|title=Immunotherapy as treatment for Alzheimer's disease |
|||
|journal=Expert Rev Neurother |
|||
|volume=7 |
|||
|issue=11 |
|||
|pages=1535–48 |
|||
|year=2007 |
|||
|month=November |
|||
|pmid=17997702 |
|||
|doi=10.1586/14737175.7.11.1535 |
|||
}} |
|||
*{{cite journal |
|||
|author=Solomon B |
|||
|title=Clinical immunologic approaches for the treatment of Alzheimer's disease |
|||
|journal=Expert Opin Investig Drugs |
|||
|volume=16 |
|||
|issue=6 |
|||
|pages=819–28 |
|||
|year=2007 |
|||
|month=June |
|||
|pmid=17501694 |
|||
|doi=10.1517/13543784.16.6.819 |
|||
}} |
|||
*{{cite journal |
|||
|author=Woodhouse A, Dickson TC, Vickers JC |
|||
|title=Vaccination strategies for Alzheimer's disease: A new hope? |
|||
|journal=Drugs Aging |
|||
|volume=24 |
|||
|issue=2 |
|||
|pages=107–19 |
|||
|year=2007 |
|||
|pmid=17313199 |
|||
|doi=10.2165/00002512-200724020-00003 |
|||
}} </ ref> Et eksempel på en slik vaksine som det ble forsket på, var ACC-001. <ref>{{cite web |url=http://www.clinicaltrials.gov/ct/show/NCT00498602 |
|||
|title = Study Evaluating ACC-001 in Mild to Moderate Alzheimers Disease Subjects |
|||
|work = Clinical Trial |publisher =US National Institutes of Health |
|||
|accessdate=2008-06-05 |
|||
|date = 2008-03-11}}</ref> <ref>{{cite web |
|||
|url=http://clinicaltrials.gov/ct2/show/NCT00479557 |title=Study Evaluating Safety, Tolerability, and Immunogenicity of ACC-001 in Subjects With Alzheimer's Disease |
|||
|publisher=US National Institutes of Health |
|||
|accessdate=2008-06-05 |
|||
}}</ref> Men forsøkene ble suspendert i 2008. <ref>{{cite web |
|||
|url=http://www.medpagetoday.com/MeetingCoverage/AAN/tb/9165 |
|||
|title = Alzheimer's Disease Vaccine Trial Suspended on Safety Concern |publisher =Medpage Today |
|||
|accessdate=2008-06-14 |
|||
|date = 2008-04-18}}</ref> En annen lignende agent er bapineuzumab et designet antistoff som er identisk med det naturlig induserte anti-amyloid antistoffet. <ref>{{cite web |
|||
|url=http://clinicaltrials.gov/ct2/show/NCT00574132 |
|||
|title= Bapineuzumab in Patients With Mild to Moderate Alzheimer's Disease/ Apo_e4 non-carriers |
|||
|work = Clinical Trial |
|||
|accessdate=2008-03-23 |
|||
|publisher= US National Institutes of Health |
|||
|date= 2008-02-29 |
|||
}}</ref> Andre tilnærminger er nervebeskyttende agenter, slik som AL-108, <ref>{{cite web |
|||
|url = http://clinicaltrials.gov/ct2/show/NCT00422981 |
|||
|title = Safety, Tolerability and Efficacy Study to Evaluate Subjects With Mild Cognitive Impairment |
|||
|work = Clinical Trial |
|||
|accessdate=2008-03-23 |
|||
|publisher= US National Institutes of Health |
|||
|date = 2008-03-11 |
|||
}}</ref> og metall-protein interaksjonsdempende agenter, for eksempel PBT2. <ref>{{cite web |
|||
|url = http://clinicaltrials.gov/ct2/show/NCT00471211 |
|||
|title = Study Evaluating the Safety, Tolerability and Efficacy of PBT2 in Patients With Early Alzheimer's Disease |
|||
|work = Clinical Trial |
|||
|accessdate=2008-03-23 |
|||
|publisher= US National Institutes of Health |
|||
|date = 2008-01-13 |
|||
}}</ref> Et TNFα reseptor fusjonsprotein har etanercept har vist oppløftende resultater. <ref name="pmid16926764">[635] ^ Etanercept research: |
|||
** {{cite journal |
|||
|author=Tobinick E, Gross H, Weinberger A, Cohen H |
|||
|title=TNF-alpha modulation for treatment of Alzheimer's disease: a 6-month pilot study |
|||
|journal=MedGenMed |
|||
|volume=8 |
|||
|issue=2 |
|||
|page=25 |
|||
|year=2006 |
|||
|pmid=16926764 |
|||
|pmc=1785182 |
|||
}} |
|||
** {{cite journal |
|||
|author=Griffin WS |
|||
|title=Perispinal etanercept: potential as an Alzheimer therapeutic |
|||
|journal=J Neuroinflammation |
|||
|volume=5 |
|||
|page=3 |
|||
|year=2008 |
|||
|pmid=18186919 |
|||
|pmc=2241592 |
|||
|doi=10.1186/1742-2094-5-3 |
|||
}} |
|||
** {{cite journal |
|||
|author=Tobinick E |
|||
|title=Perispinal etanercept for treatment of Alzheimer's disease |
|||
|journal=Curr Alzheimer Res |
|||
|volume=4 |
|||
|issue=5 |
|||
|pages=550–2 |
|||
|year=2007 |
|||
|month=December |
|||
|pmid=18220520 |
|||
|doi=10.2174/156720507783018217 |
|||
}}</ref> |
|||
I 2008 viste to separate kliniske studier positive resultater i å endre forløpet av sykdommen i mild til moderat Alzheimers med metyltioninklorid (preparatnavn ''rember'' ), et stoff som hemmer tau-aggregering, <ref>{{cite journal |
|||
|title=Tau aggregation inhibitor (TAI) therapy with remberTM arrests disease progression in mild and moderate Alzheimer's disease over 50 weeks |
|||
|author=Wischik Claude M, Bentham Peter, Wischik Damon J, Seng Kwang Meng |
|||
|journal=Alzheimer's & Dementia |
|||
|publisher=Alzheimer's Association |
|||
|year=2008 |
|||
|month=July |
|||
|volume=4 |
|||
|issue=4 |
|||
|page=T167 |
|||
|url=http://www.abstractsonline.com/viewer/viewAbstractPrintFriendly.asp?CKey={E7C717CF-8D73-41E0-8DB0-FA92205978CD}&SKey={68E04DB5-AB1C-4F7B-9511-DA3173F4F755}&MKey={CFC5F7C6-CB6A-40C4-BC87-B30C9E64B1CC}&AKey={50E1744A-0C52-45B2-BF85-2A798BF24E02} |
|||
|accessdate=2008-07-30 |
|||
|doi=10.1016/j.jalz.2008.05.438 |
|||
}}</ref> <ref> |
|||
{{cite journal |
|||
|author=Harrington Charles, Rickard Janet E, Horsley David, ''et al.'' |
|||
|title=Methylthioninium chloride (MTC) acts as a Tau aggregation inhibitor (TAI) in a cellular model and reverses Tau pathology in transgenic mouse models of Alzheimer's disease |
|||
|journal=Alzheimer's & Dementia |
|||
|publisher=Alzheimer's Association |
|||
|year=2008 |
|||
|month=July |
|||
|pages=T120–T121 |
|||
|doi=10.1016/j.jalz.2008.05.259 |
|||
|volume=4 |
|||
}}</ref> og dimebon, et antihistamin. <ref name="pmid18640457">{{cite journal |
|||
|author=Doody RS, Gavrilova SI, Sano M, ''et al.'' |
|||
|title=Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer's disease: a randomised, double-blind, placebo-controlled study |
|||
|journal=Lancet |
|||
|volume=372 |
|||
|issue=9634 |
|||
|pages=207–15 |
|||
|year=2008 |
|||
|month=July |
|||
|pmid=18640457 |
|||
|doi=10.1016/S0140-6736(08)61074-0 |
|||
}}</ref> |
|||
De påfølgende fase-III studiene av Dimebon klarte ikke å vise positive effekter i primære og sekundære endepunkter. <ref>[642] ^ [http://www.alzforum.org/new/detail.asp?id=2387 Dimebon Disappoints in Phase 3 Trial]</ref> |
|||
Muligheten for at Alzheimers kan behandles med antivirale medikamenter er foreslått av en studie som viser samlokalisering av herpes simplex-virus med amyloid plakk. <ref>{{cite journal |author=Wozniak M, Mee A, Itzhaki R |title=Herpes simplex virus type 1 DNA is located within Alzheimer's disease amyloid plaques |journal=J Pathol |volume=217 |issue=1 |pages=131–138 |year=2008 |pmid=18973185 |doi=10.1002/path.2449}}</ref> |
|||
Foreløpig forskning på virkningene av meditasjon på fremhenting av minner og kognitive funksjoner, har vært oppmuntrende. Begrensninger av denne forskningen kan bli tatt opp i fremtidige studier med mer detaljerte analyser. <ref> {{cite journal |pages=517–26 |last1=Newberg |first1=AB |issue=2 |last2=Wintering |first2=N |last3=Khalsa |first3=DS |last4=Roggenkamp |first4=H |last5=Waldman |first5=MR |author8=Newberg AB, Wintering N, Khalsa DS, Roggenkamp H, Waldman MR |volume=20 |title=Meditation effects on cognitive function and cerebral blood flow in subjects with memory loss: a preliminary study |year=2010 |journal=[[Journal of Alzheimer's Disease]] |url=http://www.j-alz.com/issues/20/vol20-2.html |pmid=20164557 |doi=10.3233/JAD-2010-1391 |doi_brokendate=2010-08-25}} (primærkilden)</ref> |
|||
==Se også== |
|||
* [[Demens|Kunst og demens]] |
|||
==Referanser== |
|||
{{Reflist|colwidth=30em}} |
|||
==Anbefalt lesing== |
|||
{{Spoken Wikipedia|Alzheimer's Disease.ogg|2008-09-12}} |
|||
*{{cite book |
|||
| title=Alzheimer's Disease: Unraveling the Mystery |
|||
| url=http://www.nia.nih.gov/Alzheimers/Publications/UnravelingTheMystery |
|||
| publisher=US Department of Health and Human Services, National Institute on Aging, NIH |
|||
| year=2008 |
|||
}} |
|||
*{{cite book |
|||
|url=http://www.nia.nih.gov/Alzheimers/Publications/ADPrevented/ |
|||
|title=Can Alzheimer's Disease Be Prevented? |
|||
|publisher=US Department of Health and Human Services, National Institute on Aging, NIH |
|||
|year=2009 |
|||
}} |
|||
*{{cite book |
|||
| title=Caring for a Person with Alzheimer's Disease: Your Easy-to-Use Guide from the National Institute on Aging |
|||
| url=http://www.nia.nih.gov/Alzheimers/Publications/CaringAD/ |
|||
| publisher=US Department of Health and Human Services, National Institute on Aging, NIH |
|||
| year=2009 |
|||
}} |
|||
*{{cite journal |
|||
|author=Cummings JL, Frank JC, Cherry D, Kohatsu ND, Kemp B, Hewett L, Mittman B |
|||
|title=Guidelines for managing Alzheimer's disease: Part I. Assessment |
|||
|journal=American Family Physician |
|||
|volume=65 |
|||
|issue=11 |
|||
|pages=2263–2272 |
|||
|year=2002 |
|||
|pmid=12074525 |
|||
|url=http://www.aafp.org/afp/20020601/2263.html |
|||
}} |
|||
*{{cite journal |
|||
|author= Cummings JL, Frank JC, Cherry D, Kohatsu ND, Kemp B, Hewett L, Mittman B |
|||
|title=Guidelines for managing Alzheimer's disease: Part II. Treatment |
|||
|journal=American Family Physician |
|||
|volume=65 |
|||
|issue=12 |
|||
|pages=2525–2534 |
|||
|year=2002 |
|||
|pmid=12086242 |
|||
|url=http://www.aafp.org/afp/20020615/2525.html |
|||
}} |
|||
*{{cite web |
|||
| title=Alzheimer's Behavior Management: Learn to manage common behavior problems |
|||
| url=http://www.helpguide.org/elder/alzheimers_behavior_problems.htm |
|||
| author=Russell D, Barston S, White M |
|||
| publisher=helpguide.org |
|||
| date=2007-12-19 |
|||
| accessdate=2008-02-29 |
|||
}} |
|||
==Eksterne lenker== |
|||
* [http://www.nasjonalforeningen.no/no/Demens/Kontakt_Demenslinjen/ Demenslinjen 81533032 |
|||
* [http://www.helsebiblioteket.no/Psykisk+helse/Alderspsykiatri Helsebibliotekets sider om alderspsykiatri] |
|||
* [http://www.helsebiblioteket.no/Psykisk+helse/Alderspsykiatri/Sk%C3%A5ringsverkt%C3%B8y?theme=8076 Skåringsverktøy (tester) for demens hos Helsebiblioteket] |
|||
* [http://www.nia.nih.gov/Alzheimers/ResearchInformation/ResearchCenters/ Alzheimer's Disease Center (ADCs)] |
|||
* [http://www.nia.nih.gov/alzheimers Alzheimer's Disease Education and Referral (ADEAR) Center] |
|||
* [http://www.alz.org/index.asp Alzheimer's Association] |
|||
* [http://memory.ucsf.edu/ UCSF Memory and Aging Center] |
|||
{{Commons category|Alzheimer's disease}} |
|||
{{-}} |
|||
{{Mental and behavioral disorders|selected = neurological}} |
|||
{{Diseases of the nervous system}} |
|||
{{Amyloidosis}} |
|||
{{featured article}} |
|||
{{Helsenotis}} |
|||
{{DEFAULTSORT:Alzheimers sykdom}} |
|||
[[Kategori:Alzheimers sykdom]] |
|||
[[Kategori:Aldringsrelaterte sykdommer]] |
|||
[[Kategori:Nevrodegenerative lidelser]] |
|||
[[Kategori:Psykiske lidelser og atferdsforstyrrelser]] |
|||
{{Link |
{{Link GA|es}} |
||
{{Link |
{{Link GA|ru}} |
||
[[af:Alzheimer se siekte]] |
[[af:Alzheimer se siekte]] |
||
| Linje 45: | Linje 3 055: | ||
[[ast:Alzheimer]] |
[[ast:Alzheimer]] |
||
[[be:Хвароба Альцгеймера]] |
[[be:Хвароба Альцгеймера]] |
||
[[be-x-old:Хвароба Альцгаймэра]] |
|||
[[bs:Alzheimerova bolest]] |
[[bs:Alzheimerova bolest]] |
||
[[bg:Болест на Алцхаймер]] |
[[bg:Болест на Алцхаймер]] |
||
| Linje 53: | Linje 3 062: | ||
[[da:Alzheimers sygdom]] |
[[da:Alzheimers sygdom]] |
||
[[de:Alzheimer-Krankheit]] |
[[de:Alzheimer-Krankheit]] |
||
[[en:Alzheimer's disease]] |
|||
[[et:Alzheimeri tõbi]] |
[[et:Alzheimeri tõbi]] |
||
[[el:Νόσος Αλτσχάιμερ]] |
[[el:Νόσος Αλτσχάιμερ]] |
||
[[en:Alzheimer's disease]] |
|||
[[es:Enfermedad de Alzheimer]] |
[[es:Enfermedad de Alzheimer]] |
||
[[eo:Alzheimer-malsano]] |
[[eo:Alzheimer-malsano]] |
||
| Linje 72: | Linje 3 082: | ||
[[it:Morbo di Alzheimer]] |
[[it:Morbo di Alzheimer]] |
||
[[he:אלצהיימר]] |
[[he:אלצהיימר]] |
||
[[sw:Ugonjwa wa Alzeima]] |
|||
[[kn:ಆಲ್ಝೈಮರ್ನ ಕಾಯಿಲೆ]] |
|||
[[sw:Ugonjwa wa Alzheimer]] |
|||
[[la:Morbus Alzheimerianus]] |
[[la:Morbus Alzheimerianus]] |
||
[[lv:Alcheimera slimība]] |
[[lv:Alcheimera slimība]] |
||
| Linje 84: | Linje 3 093: | ||
[[nl:Ziekte van Alzheimer]] |
[[nl:Ziekte van Alzheimer]] |
||
[[ja:アルツハイマー型認知症]] |
[[ja:アルツハイマー型認知症]] |
||
[[pnb:الزایمر]] |
[[pnb:الزایمر]] |
||
[[pl:Choroba Alzheimera]] |
[[pl:Choroba Alzheimera]] |
||
Sideversjonen fra 21. nov. 2010 kl. 19:44
| Alzheimers sykdom | |||
|---|---|---|---|
 | |||
| Område(r) | Nevrologi[1] | ||
| Symptom(er) | Minnetap med innvirkning på dagliglivet,[2] desorientering for tid og sted,[2] vanskeligheter med planlegging og gjennomføring av oppgaver,[2] vanskeligheter med å utføre oppgaver i hjemmet, på arbeidsplassen eller i fritiden, vanskeligheter med å tolke synsintrykk og romforhold,[2] nedsatt eller dårlig dømmekraft,[2] tilbaketrekking fra arbeidsliv og sosialt liv,[2] vanskeligheter med tale- og skriftspråk,[2] stemnings, og personlighetsendringer, feilplassering av ting og tap av evnen til å tenke tilbake,[2] demens[1] | ||
| Ekstern informasjon | |||
| ICD-10-kode | G30, F00 | ||
| ICD-9-kode | 331.0, 290.1 | ||
| ICPC-2 | P70 | ||
| OMIM | 104300 | ||
| DiseasesDB | 490 | ||
| MedlinePlus | 000760 | ||
| eMedicine | neuro/13 | ||
| MeSH | D000544 | ||
Alzheimers sykdom også kalt senil demens av Alzheimers type, primær degenerativ demens av Alzheimers type (PDDAT), eller Alzheimers er den vanligste formen for demens. Denne uhelbredelige, degenerative og terminale sykdommen ble først beskrevet i 1906 av den tyske psykiateren og nevropatologen Alois Alzheimer og ble oppkalt etter ham. [3] Oftest diagnostiseres den hos personer over 65 år. [4] Den mindre utbredte tilstanden tidlig debut Alzheimers kan oppstå mye tidligere. I 2006 var det 26,6 millioner pasienter som led av denne sykdommen i hele verden. Alzheimers er spådd å ramme en av 85 mennesker globalt innen 2050. [5]
Selv om forløpet av Alzheimers sykdom er unikt for hver enkelt, er det mange felles symptomer. [6] De tidligste observerbare symptomer er ofte feilaktig antatt å være "alders-relaterte" bekymringer eller manifestasjoner av stress. [7] I de tidlige stadiene er det vanligst observerte symptomet en manglende evne til å tilegne seg nye minner, slik som vanskeligheter med å gjenkalle nylig observerte fakta. Når Alzheimers mistenkes, blir diagnosen vanligvis bekreftet med atferdsmessige vurderinger og kognitive tester, ofte etterfulgt av en hjerneskanning hvis tilgjengelig. [8]
Etter hvert som sykdommen forverres, omfatter symptomene forvirring, irritabilitet og aggresjon, humørsvingninger, nedbrytning av språkferdigheter, tap av langtidshukommelse, generell tilbaketrekning av den lidende ettersom sansene svekkes. [7] [9] Gradvis går kroppsfunksjonene tapt, noe som til slutt fører til døden. [10] Individuell prognose er vanskelig å vurdere, siden varigheten av sykdommen varierer. Alzheimers utvikler seg i en ubestemt periode før den blir helt åpenbar, og den kan forbli udiagnostisert i mange år. Den gjennomsnittlige levealderen etter diagnose er ca sju år. [11] Færre enn tre prosent av pasientene lever mer enn 14 år etter diagnose. [12]
Årsaken til, og progresjonen av, Alzheimers sykdom er ikke godt forstått. Forskning viser at sykdommen er forbundet med plakk og fiberknuter i hjernen. [13] Dagens behandlinger har liten symptomatisk nytte, ingen behandling for å utsette eller stanse utviklingen av sykdommen er foreløpig tilgjengelig. Per 2008[oppdater] Mer enn 500 kliniske studier har blitt gjennomført for å identifisere en mulig behandling for Alzheimers, men det er ukjent om noen av de testede intervensjonsstrategiene vil vise lovende resultater. [14] En rekke ikke-invasive, livsstilsvaner har blitt foreslått for å forebygge Alzheimers sykdom, men det er mangel på adekvat dokumentasjon for en sammenheng mellom disse anbefalingene og redusert degenerasjon. Mental stimulering, mosjon og et balansert kosthold er foreslått, både som en mulig forebygging og en fornuftig måte å håndtere sykdommen på. [15]
Fordi Alzheimers ikke kan kureres og er degenerativ, er omsorg for pasientene viktig. Den viktigste omsorgspersonen er ofte ektefellen eller en nær slektning. [16] Alzheimers sykdom er kjent for å legge en stor belastning på omsorgspersoner, og presset kan være omfattende. Det kreves mye, både sosialt, psykologisk, fysisk og økonomisk av omsorgspersonen. [17] [18] [19] I utviklede land er Alzheimers en av de mest kostbare sykdommene for samfunnet. [20] [21]
Kjennetegn
Sykdommens forløp er delt inn i fire trinn, med progressive mønstre for kognitiv svikt og funksjonssvikt.
Pre-demens
De første symptomene er ofte forvekslet som relatert til alder eller stress. [7] Detaljerte nevropsykologiske tester kan avsløre milde kognitive vansker opp til åtte år før en person oppfyller kliniske kriterier for diagnostisering av Alzheimers. [22] Disse tidlige symptomene kan påvirke de mest komplekse daglige gjøremålene. [23] Den mest merkbare svekkelsen er hukommelsestap, som viser seg som vansker med å huske nylig lærte fakta og manglende evne til å tilegne seg ny informasjon. [22] [24]
Subtile problemer med eksekutivfunksjoner som krever oppmerksomhet, planlegging, fleksibilitet og abstrakt tenkning, eller svekkelser i semantisk minne (minne av betydninger og begrepsrelasjoner), kan også være symptomer på tidlige stadier av Alzheimers. [22] Apati kan observeres på dette stadiet, og er fortsatt det mest vedvarende nevropsykiatriske symptomet gjennom hele sykdomsforløpet. [25] De prekliniske stadier av sykdommen har også blitt kalt mild kognitiv svekkelse [24], men om dette begrepet tilsvarer et annet diagnostisk trinn eller identifiserer det første trinnet i Alzheimers, er omstridt. [26]
Tidlig Alzheimers
Hos personer med Alzheimers fører den økende svekkelse av læring og hukommelse til slutt til en definitiv diagnose. Hos noen få av disse personene er vanskeligheter med språket, eksekutivfunksjoner, persepsjon (agnosi) eller gjennomføring av bevegelser (apraksi) mer fremtredende enn problemer med hukommelsen. [27] Alzheimers påvirker ikke all minnekapasitet likt. Eldre minner fra pasientens liv (episodisk minne), fakta lært (semantisk minne) og implisitt hukommelse (kroppens minne om hvordan man gjør ting, som å bruke en gaffel til å spise) påvirkes i mindre grad enn nye fakta eller minner. [28] [29]
Språkproblemer er hovedsakelig preget av et krympende ordforråd og redusert ordflyt, noe som fører til en generell utarming av muntlig og skriftlig språk. [27] [30] I denne fasen er personer med Alzheimers vanligvis i stand til å kommunisere grunnleggende ideer. [27] [30] [31] Svekkelse i utføring av motoriske oppgaver som skriving, tegning eller påkledning, koordinering av visse bevegelser og vansker med planlegging kan være tilstede, men de er ofte ubemerket. [27] Etter hvert som sykdommen utvikler seg, kan Alzheimers-pasienter ofte fortsette å utføre mange oppgaver selvstendig, men kan trenge hjelp eller tilsyn med de kognitivt mest krevende aktivitetene. [27]
Moderat Alzheimers
Progressiv forverring hindrer til slutt uavhengighet. Pasientene kan etter hvert ikke utføre de fleste vanlige daglige gjøremål. [27] Talevansker blir tydelige på grunn av en manglende evne til å huske ord, noe som fører til hyppig feil bruk av ord (parafasi). Lese-og skriveferdigheter går også gradvis tapt. [27] [31] Komplekse motoriske sekvenser blir mindre koordinerte ettersom tiden går og Alzheimers utvikler seg, slik at risikoen for å falle øker. [27] I løpet av denne fasen forverres hukommelsesproblemene, og det hender at pasienten ikke gjenkjenner nære slektninger. [27] Langtidsminne, som tidligere var intakt, blir svekket. [27]
Atferds-og nevropsykiatriske endringer blir mer uttalte. Vanlige manifestasjoner er vandring, irritabilitet og labil affekt som fører til gråt, utbrudd av spontan aggresjon eller motstand mot omsorg. [27] "Sundowning" kan også forekomme, dette er en tilstand hvor personen blir mer forvirret eller agitert sent på ettermiddagen eller tidlig på kvelden. [32] Omtrent 30 % av pasientene utvikler feilidentifisering og andre symptomer på vrangforestillinger. [27] Pasientene mister også innsikt i sykdomsprosessen sin og i sine egne begrensninger (anosognosi). [27] Inkontinens kan utvikles. [27] Disse symptomene skaper stress for pårørende og omsorgspersoner. Dette kan reduseres ved å flytte pasienten fra hjemmet til institusjon. [27] [33]
Fremskreden Alzheimers
Under denne siste fasen av Alzheimers er pasienten helt avhengig av hjelp. [27] Språket er redusert til enkle setninger eller enkelte ord, og til slutt forsvinner evnen til å snakke helt. [27] [31] Til tross for tapet av verbale språkferdigheter, kan pasienter ofte forstå og gjengjelde emosjonelle signaler. [27] Selv om aggressivitet fortsatt kan være til stede, er ekstrem apati og utmattelse mye vanligere. [27] Pasientene vil til slutt ikke kunne utføre selv de enkleste oppgaver uten hjelp. [27] Muskelmasse og mobilitet forringes til et punkt der de er sengeliggende, og de mister evnen til å spise selv. [27] Alzheimers er en dødelig sykdom der dødsårsaken typisk vil være en ytre faktor som infeksjon av trykksår eller lungebetennelse, ikke selve sykdommen. [27]
Årsaker
Flere konkurrerende hypoteser prøver å forklare årsaken til sykdommen. Den eldste, som de fleste tilgjengelige medisinske behandlinger er basert på, er den kolinerge hypotesen [34] som foreslår at Alzheimers skyldes redusert syntese av signalstoffet acetylkolin. Den kolinerge hypotesen har ikke lenger bred støtte, hovedsakelig fordi medisiner beregnet på å behandle acetylkolinmangelen ikke har vært veldig effektive. Andre kolinerge effekter har også blitt foreslått, for eksempel initiering av store ansamlinger av amyloid, [35] som fører til generalisert nevroinflammasjon. [36]
I 1991 postulerte amyloidhypotesen at amyloid beta (Aβ) avleiringer er den grunnleggende årsaken til sykdommen. [37] [38] Støtte for dette postulatet kommer fra plasseringen av genet for amyloid beta forløperprotein (APP) på kromosom 21, sammen med det faktum at folk med trisomi 21 (Downs syndrom) som har en ekstra genkopi, nesten alltid får Alzheimers i 40-årsalderen. [39] [40] Også APOE4, den viktigste genetiske risikofaktoren for Alzheimers, fører til stor ansamling av amyloid i hjernen før alzheimerssymptomer oppstår. Dermed skjer Aβ-deponering forut for klinisk Alzheimers. [41] Ytterligere dokumentasjon kommer fra det faktum at transgene mus som uttrykker en mutant form av det menneskelige APP-genet, utvikler fibrillært amyloidplakk og Alzheimerslignende hjernepatologi med spatielle læringsproblemer. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref> Forskere har blitt ledet til å mistenke ikke-plakk Aβ-oligomerer (aggregater av mange monomerer) som primær sykdomsfremkallende form av Aβ. Disse giftige oligomerene, også kalt amyloid-avledede diffusible ligander (ADDLs), binder seg til en overflatereseptor på nerveceller og endrer strukturen av synapsen, og forstyrrer derved nervekommunikasjon. [42]
En reseptor for Aβ-oligomerer kan være prionproteinet, det samme proteinet som har vært knyttet til kugalskap og den relaterte menneskelige tilstanden, Creutzfeldt-Jakobs sykdom. Den kan dermed potensielt knytte den underliggende mekanisme av disse nevrodegenerative lidelsene sammen med Alzheimers sykdom. [43]
I 2009 ble denne teorien oppdatert, noe som tyder på at en nær slektning av beta-amyloid protein, og ikke nødvendigvis beta-amyloid i seg selv, kan være en årsak til sykdommen. Teorien hevder at en amyloid-relatert mekanisme som poder nevronkoblinger i hjernen i den raske vekstfasen tidlig i livet kan bli utløst av aldrings-relaterte prosesser senere i livet og føre til ødeleggelsen av nerveceller i Alzheimers sykdom. [44] N-APP, et fragment av APP fra peptidets N-terminus, ligner beta-amyloid og spaltes fra APP av et av de samme enzymene. N-APP utløser selvdestrueringsveien ved å binde seg til en reseptor kalt nevronal dødsreseptor 6 (DR6, også kjent som TNFRSF21). [44] DR6 er i høy grad uttrykt i de menneskelige hjerneregionene som er mest berørt av Alzheimers, så det er mulig at N-APP/DR6 veien kan bli kapret i den aldrende hjernen og forårsake skade. I denne modellen spiller beta-amyloid en komplementær rolle, ved å undertrykke synapsenes funksjon.
En studie fra 2004 fant at deponering av amyloid plakk ikke korrelerer godt med tap av nevroner. [45] Denne observasjonen støtter tau-hypotesen , ideen om at tau-protein-abnormiteter starter sykdomskaskaden. [38] I denne modellen begynner hyperfosforylert tau å pare seg med andre tråder av tau. Etter hvert danner de nevrofibrillære fiberknuter inne i nervecellene. [46] Når dette skjer, disintegrerer mikrotubuli, og nervecellens transportsystem kollapser. [47] Dette kan resultere først i feil i biokjemisk kommunikasjon mellom nevroner, og senere i celledød. [48] Herpes simplex-virus type 1 har også blitt foreslått å spille en utløsende rolle hos mennesker som er bærere av de mottakelige versjonene av apoE-genet. [49]
En annen hypotese hevder at sykdommen kan være forårsaket av alders-relatert myelinsammenbrudd i hjernen. Demyelinisering fører til forstyrrelser i aksonal transport, noe som fører til tap av nevroner som blir bedervet. Jern som utskilles i løpet av myelinsammenbrudd, er antatt å forårsake ytterligere skade. Homeostatiske myelinreparasjonsprosesser bidrar til utvikling av proteinavleiringer som amyloid-beta og tau. [50] [51] [52]
Oksidativt stress er en vesentlig årsak i sykdomsdannelsen. [53]
Alzheimerspasienter viser 70 % tap av locus coeruleus-celler som avgir noradrenalin som (i tillegg til sin rolle som nevrotransmitter) lokalt diffunderer fra "åreknuter" som et endogent antiinflammatorisk middel i mikromiljøet rundt nervecellene, gliacellene, og blodkar i neocortex og hippocampus. [54] Det er vist at noradrenalin stimulerer mikroglia hos mus til å undertrykke Aβ-indusert produksjon av cytokiner og deres fagocytose av Aβ. [54] Dette tyder på at degenerasjon av locus ceruleus kan være ansvarlig for økt Aβ- deponering i alzheimersrammede hjerner. [54]
Patofysiologi
Utdypende artikkel: Biochemistry of Alzheimer's disease
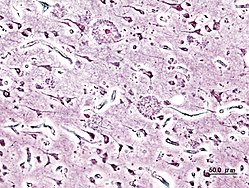
Nevropatologi
Alzheimers sykdom karakteriseres av tap av nevroner og synapser i hjernebarken og enkelte subkortikale regioner. Dette tapet resulterer i atrofi av de berørte regionene, inkludert degenerasjon i tinninglappen og parietallappen og deler av frontal cortex og cingulate gyrus [36] Studier ved hjelp av MR og PET har dokumentert reduksjon av størrelsen på bestemte områder av hjernen hos pasienter samtidig som de utviklet seg fra mild kognitiv svekkelse til Alzheimers sykdom, og i sammenligning med tilsvarende bilder fra friske eldre voksne. [55]
Både amyloid plakk og neurofibrillære fiberknuter er klart synlige ved mikroskopi av hjernen til dem som er rammet av Alzheimers. [13] Plakk er tette, for det meste uløselige forekomster av amyloid-beta peptid og cellemateriale utenfor og rundt nervecellene. Fiberknuter (nevrofibrillære floker) er oppsamlinger av det microtubuli-assosierte proteinet tau som har blitt hyperfosforylisert og akkumulert inne i cellene selv. Mange eldre utvikler plakk og fiberknuter som følge av aldring, men hjernen til Alzheimers-pasienter har et større antall av dem i bestemte områder av hjernen som tinninglappen. [56] Lewy-legemer er ikke sjeldne i alzheimerspasientens hjerne. [57]
Biokjemi

Alzheimers sykdom har blitt identifisert som en protein sykdom (proteopati) relatert til feilaktige sammenføyninger av proteiner, forårsaket av opphopning av unormalt brettede A-beta og tau-proteiner i hjernen. [58] Plakk består av små peptider, 39-43 aminosyrer lang, kalt beta-amyloid (også skrevet som A-beta eller Aβ). Beta-amyloid er et fragment fra et større protein kalt amyloid forløperprotein (APP), et transmembran-protein som penetrerer gjennom nevronets membran. APP er kritisk viktig for nevronvekst og overlevelse og reparasjon etter skade. [59] [60] Ved Alzheimers sykdom fører en ukjent prosess til at APP deles opp i mindre fragmenter av enzymer gjennom proteolyse. [61] Ett av disse fragmentene gir opphav til fibriller av beta-amyloid, som danner klumper som avleires utenfor nevroner i tette formasjoner som kalles senilt plakk. [13] [62]

Alzheimers er også ansett som en tauopati på grunn av unormal aggregering av tau-protein. Hver nervecelle har et cytoskjelett, en intern støttestruktur som delvis består av strukturer som kalles mikrotubuli. Disse mikrotubuli oppfører seg som skinner, og fører næringsstoffer og molekyler fra cellelegemet til endene av aksonene og tilbake. Et protein kalt Tau stabiliserer mikrotubuli når det er fosforylert, og kalles derfor et mikrotubulus-assosiert protein. Ved Alzheimers gjennomgår tau kjemiske endringer, blir hyperfosforylert, det begynner da å koble seg sammen med andre tråder, skaper neurofibrillære fiberknuter, og nevronets transportsystem går i oppløsning. [63]
Sykdomsmekanisme
Nøyaktig hvordan forstyrrelser av produksjon og aggregering av beta-amyloid-peptid gir opphav til Alzheimer-patologi er ikke kjent. [64] Amyloid-hypotesen peker tradisjonelt på opphopning av beta-amyloid-peptider som den sentrale hendelsen som utløser degenerering av nevroner. Akkumulering av amyloid-fibriller, som antas å være den giftige formen for protein, er ansvarlig for å forstyrre cellens kalsium-ion-homeostase og induserer programmert celledød (apoptose). [65] Det er også kjent at Aβ selektivt bygger seg opp i mitokondriene i cellene i Alzheimers-pasienters hjerne, og det hemmer også visse enzymfunksjoner og utnyttelse av glukose hos nevronene. [66]
Ulike inflammatoriske prosesser og cytokiner kan også ha en rolle i patologien bak Alzheimers sykdom. Betennelse er en generell markør for vevsskader i alle sykdommer, og kan enten være sekundært til vevsskade i Alzheimers eller en markør for en immunologisk respons. [67]
Endringer i fordelingen av ulike nevrotrope faktorer og i uttrykk for deres reseptorer som hjernederivert nevrotrop faktor (BDNF) har blitt beskrevet ved Alzheimers. [68] [69]
Genetikk
De aller fleste tilfeller av Alzheimers sykdom er sporadiske, noe som betyr at de ikke er genetisk arvet, selv om noen gener kan opptre som risikofaktorer. På den annen side, rundt 0,1 % av tilfellene er familiære former for autosomal-dominant arv, som vanligvis har en debut før fylte 65 år. [70]
De fleste tilfeller av autosomal dominant familiær Alzheimrs kan tilskrives mutasjoner i ett av tre gener: amyloid forløperprotein (APP) og preseniliner 1 og 2. [71] De fleste mutasjoner i APP og presenilin-gener øker produksjonen av et lite protein kalt Aβ 42, som er den viktigste komponenten i senile plakk. [72] Noen av mutasjonene endrer bare størrelsesforholdet mellom Aβ42 og de andre viktige former, for eksempel Aβ40, uten å øke Aβ42-nivåer. [72] [73] Dette tyder på at presenilin-mutasjoner kan forårsake sykdom, selv om den lavere totale mengden Aβ produsert også kan peke på andre roller for presenilin eller en rolle for endringer i funksjonen av APP og / eller dets fragmenter enn Aβ.
De fleste tilfeller av Alzheimers sykdom viser ikke autosomal-dominant arv og kalles sporadisk Alzheimer. Genetiske forskjeller kan likevel fungere som risikofaktorer. Den mest kjente genetiske risikofaktor er arv av ε4-allelet av apolipoprotein E (APOE). [74] [75] Mellom 40 og 80 % av pasientene med Alzheimers har minst ett apoE4 allel. [75] APOE4-allelet øker risikoen for sykdommen med tre ganger hos heterozygote (toeggede) tvillinger og med 15 ganger hos homozygote (eneggede) tvillinger. [70] Genetikere er enige om at mange andre gener også fungerer som risikofaktorer eller har beskyttende effekter som påvirker utviklingen av sen debut Alzheimers sykdom. [71] Over 400 gener har blitt testet for tilknytning til sent innsettende sporadisk Alzheimers, [71]de fleste med null resultat. [70]
Diagnostikk

Alzheimers sykdom er vanligvis diagnostisert klinisk utfra pasientens historie, sammenholdt med slektningers historie og kliniske observasjoner, basert på tilstedeværelse av karakteristiske nevrologiske og nevropsykologiske funksjoner og fravær av andre mulige sykdommer. [76] [77] Avansert medisinsk bildediagnostikk med computertomografi (CT) eller magnetisk resonans-imaging (MRI), og med "single photon emission computed tomografi" (SPECT) eller "positron-emisjons-tomografi" (PET) kan brukes til å ekskludere annen cerebral patologi eller undergrupper av demens. [78] Videre kan det forutsi overgang fra prodromalstadier (mild kognitiv svekkelse) til Alzheimers sykdom. [79]
Vurdering av intellektuell fungering, inkludert minnetesting, kan videre karakterisere sykdommens stadium. [7] Medisinske organisasjoner har skapt diagnostiske kriterier for å lette og standardisere den diagnostiske prosessen for praktiserende leger. Diagnosen kan bekreftes med svært høy nøyaktighet ved obduksjon når hjernematerialet er tilgjengelig og kan bli undersøkt histologisk. [80]
Diagnostiske kriterier
De amerikanske organisasjonene The National Institute of Neurological and Communicative Disorders and Stroke (NINCDS) og Alzheimer's Disease and Related Disorders Association (ADRDA, nå kjent som Alzheimer's Association), etablerte den mest brukte NINCDS-ADRDA Alzheimers kriterier for diagnose i 1984, [80] som ble grundig revidert i 2007. [81] Disse kriteriene krever tilstedeværelsen av kognitiv svekkelse og et mistenkt demenssyndrom, bekreftet ved nevropsykologisk testing for en klinisk diagnose av mulig eller sannsynlig Alzheimers. En histopatologisk bekreftelse inkludert en mikroskopisk undersøkelse av hjernevev er nødvendig for en definitiv diagnose. God statistisk reliabilitet og validitet har blitt vist mellom de diagnostiske kriteriene og definitiv histopatologisk bekreftelse. [82] Åtte kognitive domener er mest svekket i Alzheimers - minne, språk, perseptuelle ferdigheter, oppmerksomhet, konstruktive evner, orientering, problemløsning og funksjonsevne. Disse domenene er sammenfallende med NINCDS-ADRDA Alzheimers-kriterier som angitt i Diagnostic and Statistical Manual of Mental Disorders (DSM-IV-TR) publisert av American Psychiatric Association. [83] [84]
Diagnostiske verktøy

Nevropsykologiske tester som Mini Mental Status (MMS) er mye brukt for å evaluere kognitiv svikt. Mer omfattende testing er nødvendig for å få resultater med høy pålitelighet, særlig i de tidligste stadier av sykdommen. [85] [86] Nevrologisk undersøkelse tidlig i Alzheimers vil vanligvis gi normale resultater, med unntak av åpenbar kognitiv svikt, som kanskje ikke avviker fra det som følger av andre sykdomsprosesser, inkludert andre årsaker til demens.
Videre nevrologiske undersøkelser er avgjørende for differensialdiagnose av Alzheimers og andre sykdommer. [7] Intervjuer med familiemedlemmer er også benyttet i vurderingen av sykdommen. Omsorgspersoner kan gi viktig informasjon om evne til å gjennomføre daglige gjøremål, så vel som reduksjonen av personens mentale fungering over tid. [79] En omsorgspersons synspunkt er spesielt viktig, siden en person med Alzheimers ofte ikke er klar over sin egen svekkelse. [87] Mange ganger har også familiene vanskeligheter med å oppdage de første demenssymptomene og kan ikke kommunisere nøyaktig informasjon til legen. [88]
En annen, nyere og objektiv markør for sykdommen, er analysen av spinalvæske for amyloid beta- eller tau-proteiner. [89]Den omfatter både total tau-protein og fosforylert tau-181P-protein-konsentrasjoner. [90] Når man søker etter disse proteinene ved hjelp av en spinalpunksjon kan man forutsi utbruddet av Alzheimers med en sensitivitet på mellom 94 % og 100 %. [90] Ved å bruke dette sammen med eksisterende bildediagnostiske teknikker, kan leger identifisere pasienter med signifikant hukommelsestap som allerede er i ferd med å utvikle sykdommen. [90] Spinalvæske-testene er kommersielt tilgjengelige, i motsetning til den nyeste bildediagnostiske teknologien. [91] Alzheimers ble diagnostisert hos en tredjedel av folk som ikke har noen symptomer i en studie i 2010, noe som betyr at sykdommen oppstår lenge før symptomene oppstår. [92]
Supplerende testing gir ekstra informasjon om noen av sidene ved sykdommen eller brukes for å utelukke andre diagnoser. Blodprøver kan identifisere andre årsaker til demens enn Alzheimers [7], årsaker som i sjeldne tilfeller kan være reversible. [93] Det er vanlig å utføre tester på skjoldbruskkjertelfunksjon, vurdere vitamin B12, utelukke syfilis, utelukke metabolske problemer (inkludert tester for nyrefunksjonen, elektrolyttnivåer og for diabetes), vurdere nivåer av tungmetaller (f.eks. bly, kvikksølv) og anemi. (Se differensialdiagnose for aldersdemens). Det er også nødvendig å utelukke delir.
Psykologiske tester for depresjon brukes, fordi depresjon kan enten være sammenfallende med Alzheimer (se depresjon ved Alzheimers sykdom), et tidlig tegn på kognitiv svikt [94], eller til og med årsaken. [95] [96]
Bildediagnostikk
Når de er tilgjengelige som diagnostiske verktøy, brukes single photon emission computed tomography (SPECT) og positronemisjonstomografi (PET) til å bekrefte en Alzheimers-diagnose i forbindelse med mental status-undersøkelse. [97] Hos en person som allerede har demens, synes SPECT å være overlegen i å differensiere Alzheimers sykdom fra andre mulige årsaker, sammenlignet med de vanlige metodene for mental testing og analyse av personens medisinske historie. [98] Fremskritt har ført til forslag om nye diagnostiske kriterier. [7] [81]
En ny teknikk som kalles PiB PET har blitt utviklet for direkte og tydelig bildebehandling av beta-amyloid-avleiringer in vivo ved hjelp av en tracer som binder seg selektivt til A-beta-avleiringer. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref>
Et lignende radiofarmasøytisk stoff for PET-skanning kalt (E) -4 - (2 - (6 - (2 - (2 - (2 - ([18 F]-fluoroethoxy) ethoxy) ethoxy) pyridin-3-yl) vinyl)-N -metyl benzenamine, eller 18 F AV-45, eller florbetapir-fluor-18, eller bare florbetapir som inneholder mer langvarig radionuklide fluor-18 har nylig blitt utviklet og testet som et mulig diagnostisk verktøy for Alzheimers. [99] [100] [101] [102] Florbetapir, som PiB, binder seg til beta-amyloid, men på grunn av bruken av fluor-18 har det en halveringstid på 110 minutter, i motsetning til PiBs radioaktive halveringstid på 20 minutter. Wong et al. fant at jo lenger levetid for traceren, jo mer akkumuleres den i hjernen til Alzheimer-pasientene, særlig i regionene kjent for å være assosiert med beta-amyloid avleiringer. [102]
En systematisk oversikt spådde at amyloid-bildeteknikker sannsynligvis vil bli brukt sammen med andre markører snarere enn som et alternativ. [103]
Volumetrisk MR kan oppdage endringer i størrelsen av hjerneregioner. Måling av de regionene som atrofierer under utvikling av Alzheimers sykdom er lovende som en diagnostisk indikator. Den kan vise seg billigere enn andre bildemetoder. [104]
Nyere studier tyder på at metabolitt-nivåer i hjernen kan brukes som biomarkører for Alzheimers sykdom. [105]
Forebygging

I dag er det ingen definitive bevis som støtter at noe bestemt tiltak er effektivt i å forebygge Alzheimers Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref>
Selv om kardiovaskulære risikofaktorer, som for eksempel hyperkolesterolemi, hypertensjon, diabetes og røyking er assosiert med en høyere risiko for start og forløp av Alzheimers, [106] [107] har ikke statiner, som er kolesterolsenkende medisiner vært effektive i å forebygge eller bedre sykdommen. [108] [109] Komponentene i en middelhavsdiett, som inkluderer frukt og grønnsaker, brød, hvete og andre kornprodukter, olivenolje, fisk og rødvin, kan alle individuelt, eller sammen, redusere risikoen og forløpet av Alzheimers sykdom. [110] Den gunstige kardiovaskulære effekten har vært foreslått som virkningsmekanismen. [110] Det er begrenset dokumentasjon på at lett til moderat bruk av alkohol, særlig rødvin, er forbundet med lavere risiko for Alzheimers. [111]
Vurderinger om bruk av vitaminer har ikke funnet nok bevis for effekt til å anbefale vitamin C, [112] E, [112] [113] eller folinsyre med eller uten vitamin 12 B, [114] som forebygging eller behandling av Alzheimers. I tillegg er vitamin E knyttet til viktige helserisikoer. [112] Studier som har undersøkt folat (B9) og andre B-vitaminer klarte ikke å vise noen signifikant sammenheng med kognitiv svikt. [115]
Langsiktig bruk av ikke-steroide anti-inflammatoriske medikamenter (NSAIDs) er assosiert med en redusert sannsynlighet for å utvikle Alzheimers. [116] Humane post mortem-studier, i dyremodeller, eller in vitro-undersøkelser støtter også tanken om at NSAIDs kan redusere betennelser relatert til amyloid plakk. [116] Men studier som undersøker deres bruk som palliativ behandling har ikke klart å vise positive resultater, og ingen forebyggingsforsøk er ennå avsluttet. [116] Curcumin fra karrikrydderet gurkemeie har vist noe effekt i å forebygge hjerneskade hos mus på grunn av sine anti-inflammatoriske egenskaper. [117] [118] Hormonbehandling, som tidligere ble brukt, antas ikke lenger å forebygge demens, og i noen tilfeller kan det også være relatert til demens. [119] [120] Det er inkonsekvent og lite overbevisende dokumentasjon for at ginkgo har noen positiv effekt på kognitiv svikt og demens, [121] og en fersk undersøkelse konkluderer med at det ikke har noen effekt i å redusere forekomsten av Alzheimers. [122] En studie over 21 år fant at kaffedrikkere som drakk 3-5 kopper per dag midt i livet, hadde en 65 % reduksjon i risiko for demens sent i livet. [123]
Personer som deltar i intellektuelle aktiviteter som lesing, spiller brettspill, fyller ut kryssord, spiller musikkinstrumenter eller deltar i vanlig sosialt interaksjon, viser en redusert risiko for Alzheimers sykdom. [124] Dette er kompatibelt med kognitiv reserve-teorien, som sier at noen livserfaringer resulterer i mer effektiv nevral funksjon som gir den enkelte en kognitiv reserve som forsinker utbruddet av demens-manifestasjoner. [124] Utdanning forsinker utbruddet av Alzheimers syndrom, men er ikke relatert til tidligere død etter diagnose. [125] Fysisk aktivitet er også forbundet med redusert risiko for Alzheimers. [125]
Noen studier har vist en økt risiko for å utvikle Alzheimers ved miljøfaktorer som inntak av metaller, spesielt aluminium [126] [127] eller eksponering for løsemidler. [128] Kvaliteten på noen av disse studiene har vært kritisert, [129] og andre studier har konkludert med at det ikke er noen sammenheng mellom disse miljømessige faktorene og utviklingen av Alzheimers. [130] [131] [132] [133]
Mens noen studier antyder at ekstremt lavfrekvente elektromagnetiske felt kan øke risikoen for Alzheimers sykdom, fant analytikere at ytterligere epidemiologiske og laboratorieundersøkelser av denne hypotesen er nødvendig. [134] Røyking er en betydelig Alzheimers risikofaktor. [135] Systemiske markører av det medfødte immunsystemet er risikofaktorer for sent innsettende Alzheimers. [136]
Behandling
Det finnes ingen kur for Alzheimers sykdom, tilgjengelige behandlinger tilbudt er av relativt liten symptomatisk nytte. Dagens behandling kan deles inn i farmasøytisk, psykososial og omsorg.
Farmasøytisk


Fire medisiner er nå godkjent av offentlige instanser som for eksempel den amerikanske Food and Drug Administration (FDA) og European Medicines Agency (EMA) til å behandle kognitive manifestasjoner av Alzheimers: tre er acetylkolinesterase-hemmere og den siste er memantin, en NMDA-reseptor antagonist . Ingen medikamenter ser ut til å utsette eller stoppe utviklingen av sykdommen.
Reduksjon av aktiviteten i kolinerge nevroner er et velkjent trekk ved Alzheimers sykdom. [137] Acetylkolinesterase-hemmere brukes for å redusere hastigheten som acetylkolin (ACH) brytes ned med, og dermed øke konsentrasjonen av ACH i hjernen og bekjempe tapet av ACH forårsaket av døde kolinerge nevroner. [138] Per 2008[oppdater]. Kolinesterasehemmere godkjent for behandling av Alzheimers symptomer er donepezil (preparatnavn Aricept ) [139], galantamin (Razadyne ) [140] og rivastigmin (preparat Exelon [141] og Exelon Patch [142] ). Det er dokumentasjon for effekten av disse medikamentene ved mild til moderat Alzheimers sykdom, [143] [144] og noe dokumentasjon for bruk i fremskredent stadium. Bare donepezil er godkjent for behandling av fremskreden Alzheimers demens. [145] Bruken av disse legemidlene ved mild kognitiv svekkelse har ikke vist noen effekt i en forsinkelse på utbruddet av Alzheimers. [146] De vanligste bivirkningene er kvalme og oppkast som begge er knyttet til kolinergt overskudd. Disse bivirkningene oppstår hos omtrent 10-20 % av pasientene og er milde til moderate i alvorlighetsgrad. Mindre vanlige bivirkninger er muskelkramper, nedsatt hjerterytme (bradykardi), redusert appetitt og vekt, og økt magesyreproduksjon. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref> Memantin (preparatnavn Akatinol, Axura, Ebixa / Abixa, Memox og Namenda ), [147] er en nonkompetitiv NMDA-reseptor antagonist først brukt som et anti-influensa-medikament. Det virker på det glutamaterge systemet ved å blokkere NMDA-reseptorer og hemme deres overstimulering av glutamat. [148] Memantin har vist seg å være moderat effektiv i behandling av moderat til alvorlig Alzheimers sykdom. Effektene i de første stadiene av Alzheimers er ukjent. [149] Rapporterte bivirkninger med memantin er sjeldne og milde, inkludert hallusinasjoner, forvirring, svimmelhet, hodepine og tretthet. [150] Kombinasjonen av memantin og donepezil har vist seg å ha "statistisk signifikant, men klinisk marginal effekt". [151]
Antipsykotiske legemidler er beskjedent nyttige for å redusere aggresjon og psykose hos alzheimerspasienter med atferdsproblemer, men er forbundet med alvorlige bivirkninger, for eksempel cerebrovaskulære hendelser, bevegelses-vanskelighet eller kognitiv svikt, som ikke tillater at de brukes rutinemessig. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref> Når de brukes på lang sikt, har de vist seg å være assosiert med økt dødelighet. [152]
Medisinsk marihuana synes å være effektiv i å forsinke Alzheimers sykdom. Den aktive ingrediensen i marihuana, THC, hindrer dannelse av avleiringer i hjernen assosiert med Alzheimers sykdom. THC ble funnet å hemme acetylcholinesterase mer effektivt enn kommersielt markedsførte legemidler. THC ble også funnet å forsinke amylogenese. [153] [154]
Psykososial intervensjon

Psykososiale tiltak brukes som et supplement til medikamentell behandling og kan klassifiseres innenfor atferds-, følelses-, kognisjons- eller stimulerings-orienterte tilnærminger. Forskning på effekt er utilgjengelig og sjelden spesifikk for Alzheimers, men fokuserer i stedet på demens generelt. [155]
Atferdsmessige tiltak forsøker å identifisere og redusere forutgående hendelser og konsekvenser av problematferd. Denne tilnærmingen har ikke vist suksess i å forbedre samlet fungering, [156] men kan bidra til å redusere en spesifikk problematferd, for eksempel inkontinens. [157] Det er mangel på data av høy kvalitet på effektiviteten av disse teknikkene for andre atferdsproblemer som vandring. [158] [159]
Emosjonsorienterte tiltak omfatter erindringsterapi, valideringsterapi, støttende psykoterapi, sensorisk integrasjon også kalt snoezelen og simulert tilstedeværelsesterapi. Støttende psykoterapi har vært gjenstand få eller ingen formelle vitenskapelige studier, men noen leger finner det nyttig i å hjelpe mildt rammede pasienter med å tilpasse seg sykdommen. [155] Erindringsterapi (RT) innebærer drøfting av tidligere erfaringer individuelt eller i gruppe, mange ganger med hjelp av fotografier, husholdningsartikler, musikk og lydopptak, eller andre kjente elementer fra fortiden. Selv om det er få kvalitetsstudier på effekten av RT, kan det være fordelaktig for kognisjon og humør. [160] Simulert tilstedeværelsesterapi (SPT) er basert på tilknytningsteorier og innebærer å spille av en innspilling med stemmene til de nærmeste slektningene for pasienten. Det finnes delvis dokumentasjon som tyder på at SPT kan redusere utfordrende atferd. [161] Valideringsterapi er basert på aksept av virkeligheten og personlig sannhet av en annens opplevelse, mens sensorisk integrasjon er basert på øvelser som har som mål å stimulere til sansene. Det er lite dokumentasjon som støtter nytten av disse terapiene. [162] [163]
Målet med kognisjons-orienterte behandlinger, som inkluderer virkelighetsorientering og kognitiv gjenlæring, er reduksjon av kognitiv svekkelse. Virkelighetsorientering består i presentasjon av informasjon om tid, sted eller person for å lette pasientens forståelse av sine omgivelser og sin plass i disse. Kognitiv gjenlæring prøver å forbedre nedsatt kapasitet ved øving av mentale evner. Begge har vist noe effekt i å bedre kognitiv kapasitet, [164] [165] men i enkelte studier var disse effektene forbigående, og negative effekter, som frustrasjon, har også blitt rapportert. [155]
Stimuleringsorienterte behandlinger inkluderer kunst, musikk og kjæledyrterapi, mosjon og alle andre typer fritidsaktiviteter. Stimulering har beskjeden vitenskapelig støtte for å bedre atferd, humør, og, i mindre grad, funksjon. Selv om disse effektene er viktige, er den viktigste støtten for bruk av stimuleringsterapi endringen i pasientens rutine. [155]
Omsorg
Utdypende artikkel: [[Caregiving and dementia]]
Siden Alzheimers ikke har noen kur, og den gradvis gjør folk ute av stand til å klare seg selv, er omsorg den viktigste behandlingen, og den må håndteres nøye gjennom hele forløpet av sykdommen.
I de tidlige og moderate stadiene vil tilpasninger av bomiljø og livsstil kunne øke pasientsikkerheten og redusere belastningen på omsorgspersonene. [166] [167] Eksempler på slike tilpasninger er etterlevelse av forenklede rutiner, plassering av sikkerhetslåser, merking av husholdninggjenstander for å hjelpe pasienten med bruk av dagligdagse gjenstander. [155] [168] [169] Pasientene kan også bli ute av stand til å mate seg selv, så de trenger å få maten i mindre biter eller most. [170] Når svelgevansker oppstår, kan bruk av materør være nødvendig. I slike tilfeller er medisinsk effekt og etikk i forhold til fortsatt mating en viktig vurdering for omsorgspersoner og familiemedlemmer. [171] [172] Bruk av fysisk tvang er sjelden indisert i noe stadium av sykdommen, selv om det er situasjoner når det er nødvendig for å hindre skade på pasientene eller deres omsorgspersoner. [155]
Etter hvert som sykdommen utvikler seg, kan forskjellige medisinske problemer vise seg, slik som sykdommer i munnhulen og tannsykdomer, trykksår, feilernæring, hygieneproblemer eller luftveis- hud- eller øyeinfeksjoner. Oppmerksom pleie kan forhindre disse, mens profesjonell behandling er nødvendig når de oppstår. [173] Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref>
En liten fersk studie fra USA konkluderte med at pasienter med omsorgspersoner som hadde en realistisk forståelse av prognose og kliniske komplikasjoner ved sen demens, hadde mindre sannsynlighet for å få aggressiv behandling nær slutten av livet. [174]
Prognose

De tidlige stadiene av Alzheimers sykdom er vanskelige å diagnostisere. En definitiv diagnose stilles vanligvis når kognitiv svekkelse hindrer utføring av daglige gjøremål, selv om personen fortsatt kan bo for seg selv. Symptomene vil utvikle seg fra milde kognitive problemer, for eksempel hukommelsestap, gjennom økende stadier av kognitive og ikke-kognitive forstyrrelser, og eliminerer til slutt enhver mulighet for selvstendig liv. [27]
Forventet levealder hos folk med sykdommen er redusert. [11] [175] [176] Den gjennomsnittlige levealder etter diagnose er ca sju år. [11] Færre enn 3 % av pasientene lever mer enn fjorten år. [12] Sykdomstegn som har vært signifikant assosiert med redusert overlevelse, er økt alvorlighetsgrad av kognitiv svikt, nedsatt funksjonsnivå, fall og nevrologiske forstyrrelser. Andre sammenfallende sykdommer som hjerteproblemer, diabetes eller tidligere alkoholmisbruk er også assosiert med kortere overlevelse. [175] [177] [178] Selv om lav alder ved debut gir høyere forventet antall års overlevelse, er den forventede levetid mye mer redusert i forhold til forventet levetid hos den friske befolkningen blant de yngre. [176] Menn har en dårligere overlevelsesprognose enn kvinner. [12] [179]
Sykdommen er den underliggende dødsårsak i 70 % av alle tilfeller. [11] Lungebetennelse og dehydrering er de hyppigste umiddelbare dødsårsaker, mens kreft er en mindre hyppig dødsårsak enn i den generelle befolkningen. [11] [179]
Epidemiologi
| - | Alder! Nye berørte per tusen person-år |
- | 65-69 | 3 | - | 70-74 | 6 | - | 75-79 | 9 | - | 80-84 | 23 | - | 85-89 | 40 | - | 90 - | 69 |
|---|
To viktige mål brukes i epidemiologiske studier: insidens og prevalens. Insidens er antall nye tilfeller per enhet av person-tid (vanligvis antall nye tilfeller per tusen person-år), mens prevalensen er det totale antall tilfeller av sykdommen i befolkningen til enhver tid.
Når det gjelder forekomst, gir kohort longitudinelle studier (studier hvor en sykdomsfri befolkning er fulgt opp gjennom årene) rater mellom 10 og 15 per tusen person-år for alle demens-sykdommer og 5-8 for Alzheimers, [180] [181] hvilket betyr at halvparten av nye demenstilfeller hvert år er Alzheimers. Høy alder er primær risikofaktor for sykdom og forekomst er ikke lik for alle aldre: hvert femte år etter fylte 65 år fordobles omtrent risikoen for å få sykdommen, og den øker fra 3 til så mye som 69 per tusen personår. [180] [181] Det er også kjønnsforskjeller i insidensen, kvinner har en høyere risiko for å utvikle Alzheimers, særlig i populasjonen eldre enn 85. [181] [182]
Utbredelse av Alzheimers i populasjoner er avhengig av ulike faktorer, inkludert forekomst og overlevelse. Siden forekomst av Alzheimers øker med alderen, er det spesielt viktig å inkludere gjennomsnittsalderen i befolkningen. I USA ble Alzheimer-prevalensen anslått til 1,6 % i 2000 både totalt og i aldersgruppen 65-74, og prevalensen økte til 19 % i 75-84 gruppen og 42 % gruppen over 84. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref> Verdens helseorganisasjon anslår at i 2005 hadde 0,379 % av mennesker over hele verden demens, og at forekomsten vil øke til 0,441 % i 2015 og til 0.556 % i 2030. [183] Andre studier har kommet til lignende konklusjoner. [184] En annen studie beregnet at i 2006 var 0,40 % av verdens befolkning (område 0,17-0,89 %; absolutte tall 26.6 million 11.4–59.4 million ) rammet av Alzheimers, og at prevalens ville tredobles, og det absolutte antallet ville firedobles i løpet av 2050. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref> Det var ikke før 1901 at den tyske psykiateren Alois Alzheimer oppdaget det første tilfellet av det som ble kjent som Alzheimers sykdom hos en femti år gammel kvinne som han kalte Auguste D. Alzheimer fulgte henne helt til hun døde i 1906, da han først rapporterte tilfellet offentlig. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref> Sykdommen ble først beskrevet som en særegen sykdom av Emil Kraepelin etter å ha undertrykket noen av de kliniske (vrangforestillinger og hallusinasjoner) og patologiske funnene (arteriosklerotiske endringer) som finnes i den opprinnelige rapporten om Auguste D. [185] Han inkluderte Alzheimers sykdom , også kalt presenil demens av Kraepelin, som en subtype av senil demens i den åttende utgaven av hans Textbook of Psychiatry , utgitt i 1910. [186]
I mesteparten av det 20. århundre var diagnostisering av Alzheimers sykdom reservert for personer mellom 45 og 65 år som hadde utviklet symptomer på demens. Terminologien ble endret etter 1977 da en konferanse om Alzheimers konkluderte med at de kliniske og patologiske manifestasjoner av presenil og senil demens var nesten identiske, selv om forfatterne også la til at dette ikke utelukker muligheten for at de hadde ulike årsaker. [187] Dette førte til slutt til diagnostisering av Alzheimers sykdom uavhengig av alder. [188] Begrepet senil demens av Alzheimers type (SDAT) ble brukt en stund for å beskrive tilstanden hos dem over 65, mens klassisk Alzheimers sykdom ble brukt for de yngre. Begrepet Alzheimers sykdom ble til slutt formelt vedtatt i medisinsk nomenklatur for å beskrive personer i alle aldre med et karakteristisk vanlig symptommønster, sykdomsforløp og nevropatologi. [189]
Samfunn og kultur
Sosiale kostnader
Demens, og spesielt Alzheimers sykdom, kan være blant de mest kostbare sykdommene for samfunnet i Europa og USA.[20] [21] Kostnadene i andre land som Argentina [190] eller Sør-Korea [191] er også høy og stigende. Disse kostnadene vil trolig øke med aldringen av befolkningen, og bli et viktig samfunnsproblem. Alzheimers-relaterte kostnader omfatter direkte helseutgifter som for eksempel sykehjemsomsorg og hjemmesykepleie, men også indirekte kostnader som for eksempel tapt produktivitet for både pasient og personell. [21] Tallene varierer mellom studier, men demens-kostnader over hele verden er beregnet til rundt 160 milliarder dollar, [192] mens kostnadene for Alzheimer i USA kan bli 100 milliarder dollar hver år. [21]
De største kostnadene for samfunnet kommer fra langsiktig omsorg av helsepersonell, og spesielt institusjonalisering noe som tilsvarer 2 / 3 av de totale kostnadene for samfunnet. [20] Kostnaden for hjemmeboende er også svært høy, [20] spesielt når uformelle kostnader for familien, for eksempel pleietid og omsorgspersonens tapte arbeidsfortjeneste blir tatt hensyn til. [193]
Kostnadene øker med alvorlighetsgrad av demens og tilstedeværelsen av adferdsforstyrrelser, [194] og de er relatert til den økte omsorgstiden som kreves for å gi fysisk omsorg. [193] Derfor vil enhver behandling som bremser kognitiv svikt, utsetter institusjonalisering eller reduserer omsorgspersonstimer, innebære økonomiske fordeler. Økonomiske evalueringer av nåværende behandlinger har vist positive resultater. [21]
Omsorgsbyrde
Utdypende artikkel: [[Caregiving and dementia]]
Rollen som viktigste omsorgsperson blir ofte tatt av ektefelle eller en nær slektning. [død lenke] [16] Alzheimers sykdom er kjent for å plassere en stor belastning på omsorgspersonene som inkluderer sosiale, psykologiske, fysiske eller økonomiske forhold. [17] [18] [19] Hjemmetjenester er vanligvis foretrukket av pasienter og familier. [195] Dette alternativet utsetter eller eliminerer også behovet for mer profesjonelle og kostbare nivåer av omsorg. [195] [196] Likevel har to tredjedeler av sykehjemsbeboere demens. [155]
Demens-omsorgspersoner er utsatt for høy forekomst av fysiske og psykiske lidelser. [197] Faktorer assosiert med større psykososiale problemer for primære omsorgspersoner inkluderer å ha en berørt person hjemme, at pleieren er en ektefelle, krevende atferd fra pasienten som depresjon, atferdsforstyrrelser, hallusinasjoner, søvnproblemer eller vandring og sosial isolasjon. [198] [199] Når det gjelder økonomiske problemer, tar omsorgspersoner i familien ofte fri fra jobben for å tilbringe i gjennomsnitt 47 timer per uke med Alzheimerspasienten, samtidig som at omsorgskostnadene er høye. Direkte og indirekte kostnader for omsorg for en Alzheimers-pasient er gjennomsnittlig mellom 18 000 dollar og 77 500 dollar per år i USA, avhengig av studien. [193] [død lenke] [200]
Kognitiv atferdsterapi og undervisning i mestringsstrategier, enten individuelt eller i gruppe, har vist effekt i å bedre omsorgspersoners psykiske helse. [17] [201]
Kjente tilfeller
Utdypende artikkel: [[Alzheimer's in the media]]

Siden Alzheimers sykdom er svært utbredt, har mange kjente mennesker utviklet dette. Kjente eksempler er tidligere USAs president Ronald Reagan og den irske forfatteren Iris Murdoch, som begge var gjenstand for vitenskapelige artikler som undersøkte hvordan deres kognitive kapasitet ble forverret med sykdommen. [202] [203] [204] Andre tilfeller er [205] tidligere statsminister Harold Wilson (Storbritannia) og Adolfo Suárez (Spania) [206] [207] skuespillerinnen Rita Hayworth [208] skuespilleren Charlton Heston og [209] forfatteren Terry Pratchett.[210]
Alzheimers har også blitt portrettert i filmer som: Iris (2001), [211] basert på John Bayleys biografi om hans kone Iris Murdoch [212]
The Notebook (2004), [213] basert på Nicholas Sparks roman med samme navn, [214] A Moment to Remember (2004); Thanmathra (2005), [215] Memories of Tomorrow (Ashita no Kioku) (2006 ), [216] basert på Hiroshi Ogiwaras roman med samme navn, [217] Away from Her (2006), basert på Alice Munros novelle, The Bear Came over the Mountain [218] og den svenske filmen En sång för Martin. Dokumentarer om Alzheimers sykdom inkluderer Malcolm og Barbara: A Love Story (1999) og Malcolm og Barbaras:Love's Farewell (2007), begge med Malcolm Pointon. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref>
Et område av klinisk forskning er fokusert på å behandle den underliggende sykdommens patologi. Reduksjon av amyloid beta-nivåer er et felles mål for forbindelser [219] (som for eksempel apomorfin) det forskes på. Immunterapi eller vaksinasjon mot amyloid-protein er en behandling som studeres. [220] I motsetning til forebyggende vaksinering, ville den antatte terapi brukes til å behandle folk som allerede er diagnostisert. Det er basert på konseptet om trening av immunsystemet til å gjenkjenne, angripe, og reversere deponering av amyloid, og dermed endre sykdomsforløpet. Siteringsfeil: Avsluttende </ref>-tagg mangler for <ref> [221] Men forsøkene ble suspendert i 2008. [222] En annen lignende agent er bapineuzumab et designet antistoff som er identisk med det naturlig induserte anti-amyloid antistoffet. [223] Andre tilnærminger er nervebeskyttende agenter, slik som AL-108, [224] og metall-protein interaksjonsdempende agenter, for eksempel PBT2. [225] Et TNFα reseptor fusjonsprotein har etanercept har vist oppløftende resultater. [226]
I 2008 viste to separate kliniske studier positive resultater i å endre forløpet av sykdommen i mild til moderat Alzheimers med metyltioninklorid (preparatnavn rember ), et stoff som hemmer tau-aggregering, [227] [228] og dimebon, et antihistamin. [229] De påfølgende fase-III studiene av Dimebon klarte ikke å vise positive effekter i primære og sekundære endepunkter. [230]
Muligheten for at Alzheimers kan behandles med antivirale medikamenter er foreslått av en studie som viser samlokalisering av herpes simplex-virus med amyloid plakk. [231]
Foreløpig forskning på virkningene av meditasjon på fremhenting av minner og kognitive funksjoner, har vært oppmuntrende. Begrensninger av denne forskningen kan bli tatt opp i fremtidige studier med mer detaljerte analyser. [232]
Se også
Referanser
- ^ a b Klinická neurologie: část speciální (tsjekkisk). ISBN 978-80-7387-389-9. Wikidata Q90835855.
- ^ a b c d e f g h http://www.alz.org/fr/10-signes-et-symptomes-d-alzheimer.asp.
- ^ Siteringsfeil: Ugyldig
<ref>-tagg; ingen tekst ble oppgitt for referansen ved navnpmid9661992 - ^ Brookmeyer R., Gray S., Kawas C. (1998). «Projections of Alzheimer's disease in the United States and the public health impact of delaying disease onset». American Journal of Public Health. 88 (9): 1337–42. PMC 1509089
 . PMID 9736873. doi:10.2105/AJPH.88.9.1337.
. PMID 9736873. doi:10.2105/AJPH.88.9.1337.
- ^ Siteringsfeil: Ugyldig
<ref>-tagg; ingen tekst ble oppgitt for referansen ved navnBrookmeyer2007 - ^ «What is Alzheimer's disease?». Alzheimers.org.uk. 2007. Besøkt 21. februar 2008.
- ^ a b c d e f g Waldemar G, Dubois B, Emre M; m.fl. (2007). «Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline». Eur J Neurol. 14 (1): e1–26. PMID 17222085. doi:10.1111/j.1468-1331.2006.01605.x.
- ^ «Alzheimer's diagnosis of AD». Alzheimer's Research Trust. Besøkt 29. februar 2008.
- ^ Tabert MH, Liu X, Doty RL, Serby M, Zamora D, Pelton GH, Marder K, Albers MW, Stern Y, Devanand DP (2005). «A 10-item smell identification scale related to risk for Alzheimer's disease». Ann. Neurol. 58 (1): 155–160. PMID 15984022. doi:10.1002/ana.20533.
- ^ «Understanding stages and symptoms of Alzheimer's disease». National Institute on Aging. 26. oktober 2007. Besøkt 21. februar 2008.
- ^ a b c d e Mölsä PK, Marttila RJ, Rinne UK (1986). «Survival and cause of death in Alzheimer's disease and multi-infarct dementia». Acta Neurol Scand. 74 (2): 103–7. PMID 3776457. doi:10.1111/j.1600-0404.1986.tb04634.x.
- ^ a b c Mölsä PK, Marttila RJ, Rinne UK (1995). «Long-term survival and predictors of mortality in Alzheimer's disease and multi-infarct dementia». ActaNeurol Scand. 91 (3): 159–64. PMID 7793228.
- ^ a b c Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (2004). «The importance of neuritic plaques and tangles to the development and evolution of AD». Neurology. 62 (11): 1984–9. PMID 15184601.
- ^ «Alzheimer's Disease Clinical Trials». US National Institutes of Health. Besøkt 18. august 2008.
- ^ «Can Alzheimer's disease be prevented» (pdf). National Institute on Aging. 29. august 2006. Besøkt 29. februar 2008.
- ^ a b «The MetLife study of Alzheimer's disease: The caregiving experience» (PDF). MetLife Mature Market Institute. 2006. Arkivert fra originalen 25. juni 2008.
- ^ a b c Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J (2007). «Systematic review of information and support interventions for caregivers of people with dementia». BMC Geriatr. 7: 18. PMC 1951962
 . PMID 17662119. doi:10.1186/1471-2318-7-18.
. PMID 17662119. doi:10.1186/1471-2318-7-18.
- ^ a b Schneider J, Murray J, Banerjee S, Mann A (1999). «EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I—Factors associated with carer burden». International Journal of Geriatric Psychiatry. 14 (8): 651–661. PMID 10489656. doi:10.1002/(SICI)1099-1166(199908)14:8<651::AID-GPS992>3.0.CO;2-B.
- ^ a b Murray J, Schneider J, Banerjee S, Mann A (1999). «EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II—A qualitative analysis of the experience of caregiving». International Journal of Geriatric Psychiatry. 14 (8): 662–667. PMID 10489657. doi:10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4. Siteringsfeil: Ugyldig
<ref>-tagg; navnet «pmid10489657» er definert flere steder med ulikt innhold - ^ a b c d Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP (2005). «Impact économique de la démence (English: The economical impact of dementia)». Presse Med. 34 (1): 35–41. PMID 15685097.
- ^ a b c d e Meek PD, McKeithan K, Schumock GT (1998). «Economic considerations in Alzheimer's disease». Pharmacotherapy. 18 (2 Pt 2): 68–73; discussion 79–82. PMID 9543467.
- ^ a b c Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ (2004). «Multiple cognitive deficits during the transition to Alzheimer's disease». J Intern Med. 256 (3): 195–204. PMID 15324363. doi:10.1111/j.1365-2796.2004.01386.x.
- ^ Nygård L (2003). «Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment?». Acta Neurol Scand. Suppl (179): 42–6. PMID 12603250. doi:10.1034/j.1600-0404.107.s179.8.x.
- ^ a b Arnáiz E, Almkvist O (2003). «Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease». Acta Neurol. Scand., Suppl. 179: 34–41. PMID 12603249. doi:10.1034/j.1600-0404.107.s179.7.x.
- ^ Landes AM, Sperry SD, Strauss ME, Geldmacher DS (2001). «Apathy in Alzheimer's disease». J Am Geriatr Soc. 49 (12): 1700–7. PMID 11844006. doi:10.1046/j.1532-5415.2001.49282.x.
- ^ Petersen RC (2007). «The current status of mild cognitive impairment—what do we tell our patients?». Nat Clin Pract Neurol. 3 (2): 60–1. PMID 17279076. doi:10.1038/ncpneuro0402.
- ^ a b c d e f g h i j k l m n o p q r s t u v w Förstl H, Kurz A (1999). «Clinical features of Alzheimer's disease». European Archives of Psychiatry and Clinical Neuroscience. 249 (6): 288–290. PMID 10653284. doi:10.1007/s004060050101.
- ^ Carlesimo GA, Oscar-Berman M (1992). «Memory deficits in Alzheimer's patients: a comprehensive review». Neuropsychol Rev. 3 (2): 119–69. PMID 1300219. doi:10.1007/BF01108841.
- ^ Jelicic M, Bonebakker AE, Bonke B (1995). «Implicit memory performance of patients with Alzheimer's disease: a brief review». International Psychogeriatrics. 7 (3): 385–392. PMID 8821346. doi:10.1017/S1041610295002134.
- ^ a b Taler V, Phillips NA (2008). «Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review». J Clin Exp Neuropsychol. 30 (5): 501–56. PMID 1856925. doi:10.1080/13803390701550128.
- ^ a b c Frank EM (1994). «Effect of Alzheimer's disease on communication function». J S C Med Assoc. 90 (9): 417–23. PMID 7967534.
- ^ Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (2001). «Sundowning and circadian rhythms in Alzheimer's disease». Am J Psychiatry. 158 (5): 704–11. PMID 11329390. doi:10.1176/appi.ajp.158.5.704. Besøkt 27. august 2008.
- ^ Gold DP, Reis MF, Markiewicz D, Andres D (1995). «When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia». J Am Geriatr Soc. 43 (1): 10–6. PMID 7806732.
- ^ Francis PT, Palmer AM, Snape M, Wilcock GK (1999). «The cholinergic hypothesis of Alzheimer's disease: a review of progress». J. Neurol. Neurosurg. Psychiatr. 66 (2): 137–47. PMC 1736202
 . PMID 10071091. doi:10.1136/jnnp.66.2.137.
. PMID 10071091. doi:10.1136/jnnp.66.2.137.
- ^ Shen ZX (2004). «Brain cholinesterases: II. The molecular and cellular basis of Alzheimer's disease». Med Hypotheses. 63 (2): 308–21. PMID 15236795. doi:10.1016/j.mehy.2004.02.031.
- ^ a b Wenk GL (2003). «Neuropathologic changes in Alzheimer's disease». J Clin Psychiatry. 64 Suppl 9: 7–10. PMID 12934968.
- ^ Hardy J, Allsop D (1991). «Amyloid deposition as the central event in the aetiology of Alzheimer's disease». Trends Pharmacol. Sci. 12 (10): 383–88. PMID 1763432. doi:10.1016/0165-6147(91)90609-V.
- ^ a b Mudher A, Lovestone S (2002). «Alzheimer's disease-do tauists and baptists finally shake hands?». Trends Neurosci. 25 (1): 22–26. PMID 11801334. doi:10.1016/S0166-2236(00)02031-2.
- ^ Nistor M, Don M, Parekh M; m.fl. (2007). «Alpha- and beta-secretase activity as a function of age and beta-amyloid in Down syndrome and normal brain». Neurobiol Aging. 28 (10): 1493–1506. PMID 16904243. doi:10.1016/j.neurobiolaging.2006.06.023.
- ^ Lott IT, Head E (2005). «Alzheimer disease and Down syndrome: factors in pathogenesis». Neurobiol Aging. 26 (3): 383–89. PMID 15639317. doi:10.1016/j.neurobiolaging.2004.08.005.
- ^ Polvikoski T, Sulkava R, Haltia M; m.fl. (1995). «Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein». N Engl J Med. 333 (19): 1242–47. PMID 7566000. doi:10.1056/NEJM199511093331902.
- ^ Lacor PN; Buniel, MC; Furlow, PW; Clemente, AS; Velasco, PT; Wood, M; Viola, KL; Klein, WL; m.fl. (2007). «Aß Oligomer-Induced Aberrations in Synapse Composition, Shape, and Density Provide a Molecular Basis for Loss of Connectivity in Alzheimer's Disease». Journal of Neuroscience. 27 (4): 796–807. PMID 17251419. doi:10.1523/JNEUROSCI.3501-06.2007.
- ^
Lauren J, Gimbel D; m.fl. (2009). «Cellular prion protein mediates impairment of synaptic plasticity by amyloid-beta oligomers». Nature. 457 (7233): 1128–32. PMC 2748841
 . PMID 19242475. doi:10.1038/nature07761.
. PMID 19242475. doi:10.1038/nature07761.
- ^ a b Nikolaev, Anatoly (19 February 2009). «N-APP binds DR6 to cause axon pruning and neuron death via distinct caspases». Nature. 457 (7232): 981–989. PMC 2677572
 . PMID 19225519. doi:10.1038/nature07767. Sjekk datoverdier i
. PMID 19225519. doi:10.1038/nature07767. Sjekk datoverdier i |besøksdato=, |dato=(hjelp); - ^ Schmitz C, Rutten BP, Pielen A; m.fl. (2004). «Hippocampal neuron loss exceeds amyloid plaque load in a transgenic mouse model of Alzheimer's disease». Am J Pathol. 164 (4): 1495–1502. PMC 1615337
 . PMID 15039236.
. PMID 15039236.
- ^ Goedert M, Spillantini MG, Crowther RA (1991). «Tau proteins and neurofibrillary degeneration». Brain Pathol. 1 (4): 279–86. PMID 1669718. doi:10.1111/j.1750-3639.1991.tb00671.x.
- ^ Iqbal K, Alonso Adel C, Chen S; m.fl. (2005). «Tau pathology in Alzheimer disease and other tauopathies». Biochim Biophys Acta. 1739 (2–3): 198–210. PMID 15615638. doi:10.1016/j.bbadis.2004.09.008.
- ^ Chun W, Johnson GV (2007). «The role of tau phosphorylation and cleavage in neuronal cell death». Front Biosci. 12: 733–56. PMID 17127334. doi:10.2741/2097.
- ^ Itzhaki RF, Wozniak MA (2008). «Herpes simplex virus type 1 in Alzheimer's disease: the enemy within». J Alzheimers Dis. 13 (4): 393–405. PMID 18487848.
- ^
[utdatert] PMID 19775776 (PMID 19775776)
Denne kilden er ikke fullstendig. Du kan utvide den manuelt - ^
[utdatert] PMID 15665415 (PMID 15665415)
Denne kilden er ikke fullstendig. Du kan utvide den manuelt - ^
[utdatert] PMID 18596894 (PMID 18596894)
Denne kilden er ikke fullstendig. Du kan utvide den manuelt - ^
[utdatert] PMID 19075578 (PMID 19075578)
Denne kilden er ikke fullstendig. Du kan utvide den manuelt - ^ a b c Heneka MT, Nadrigny F, Regen T, Martinez-Hernandez A, Dumitrescu-Ozimek L, Terwel D, Jardanhazi-Kurutz D, Walter J, Kirchhoff F, Hanisch UK, Kummer MP. (2010). Locus ceruleus controls Alzheimer's disease pathology by modulating microglial functions through norepinephrine. Proc Natl Acad Sci USA A. 107:6058-6063 doi:10.1073/pnas.0909586107 PMID 20231476
- ^ Moan R (July 20, 2009). «MRI software accurately IDs preclinical Alzheimer's disease». Diagnostic Imaging. Sjekk datoverdier i
|dato=(hjelp) - ^ Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). «Regional distribution of neurofibrillary tangles and senile plaques in the cerebral cortex of elderly patients: a quantitative evaluation of a one-year autopsy population from a geriatric hospital». Cereb. Cortex. 4 (2): 138–50. PMID 8038565. doi:10.1093/cercor/4.2.138.
- ^ Kotzbauer PT, Trojanowsk JQ, Lee VM (2001). «Lewy body pathology in Alzheimer's disease». J Mol Neurosci. 17 (2): 225–32. PMID 11816795. doi:10.1385/JMN:17:2:225.
- ^ Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). «Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer's and Parkinson's diseases». Neuromolecular Med. 4 (1–2): 21–36. PMID 14528050. doi:10.1385/NMM:4:1-2:21.
- ^ Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (2006). «Synapse formation and function is modulated by the amyloid precursor protein». J. Neurosci. 26 (27): 7212–21. PMID 16822978. doi:10.1523/JNEUROSCI.1450-06.2006.
- ^ Turner PR, O'Connor K, Tate WP, Abraham WC (2003). «Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory». Prog. Neurobiol. 70 (1): 1–32. PMID 12927332. doi:10.1016/S0301-0082(03)00089-3 begin_of_the_skype_highlighting 0082(03)00089-3 end_of_the_skype_highlighting begin_of_the_skype_highlighting 0082(03)00089-3 end_of_the_skype_highlighting Sjekk
|doi=-verdien (hjelp). - ^ Hooper NM (2005). «Roles of proteolysis and lipid rafts in the processing of the amyloid precursor protein and prion protein». Biochem. Soc. Trans. 33 (Pt 2): 335–8. PMID 15787600. doi:10.1042/BST0330335.
- ^ Ohnishi S, Takano K (2004). «Amyloid fibrils from the viewpoint of protein folding». Cell. Mol. Life Sci. 61 (5): 511–24. PMID 15004691. doi:10.1007/s00018-003-3264-8.
- ^ Hernández F, Avila J (2007). «Tauopathies». Cell. Mol. Life Sci. 64 (17): 2219–33. PMID 17604998. doi:10.1007/s00018-007-7220-x.
- ^ Van Broeck B, Van Broeckhoven C, Kumar-Singh S (2007). «Current insights into molecular mechanisms of Alzheimer disease and their implications for therapeutic approaches». Neurodegener Dis. 4 (5): 349–65. PMID 17622778. doi:10.1159/000105156.
- ^ Yankner BA, Duffy LK, Kirschner DA (1990). «Neurotrophic and neurotoxic effects of amyloid beta protein: reversal by tachykinin neuropeptides». Science (journal). 250 (4978): 279–82. PMID 2218531. doi:10.1126/science.2218531.
- ^ Chen X, Yan SD (2006). «Mitochondrial Abeta: a potential cause of metabolic dysfunction in Alzheimer's disease». IUBMB Life. 58 (12): 686–94. PMID 17424907. doi:10.1080/15216540601047767.
- ^ Greig NH, Mattson MP, Perry T; m.fl. (2004). «New therapeutic strategies and drug candidates for neurodegenerative diseases: p53 and TNF-alpha inhibitors, and GLP-1 receptor agonists». Ann. N. Y. Acad. Sci. 1035: 290–315. PMID 15681814. doi:10.1196/annals.1332.018.
- ^ Tapia-Arancibia L, Aliaga E, Silhol M, Arancibia S (2008). «New insights into brain BDNF function in normal aging and Alzheimer disease». Brain Research Reviews. 59 (1): 201–20. PMID 18708092. doi:10.1016/j.brainresrev.2008.07.007.
- ^ Schindowski K, Belarbi K, Buée L (2008). «Neurotrophic factors in Alzheimer's disease: role of axonal transport». Genes, Brain and Behavior. 7 (Suppl 1): 43–56. PMC 2228393
 . PMID 18184369. doi:10.1111/j.1601-183X.2007.00378.x.
. PMID 18184369. doi:10.1111/j.1601-183X.2007.00378.x.
- ^ a b c Blennow K, de Leon MJ, Zetterberg H (2006). «Alzheimer's disease». Lancet. 368 (9533): 387–403. PMID 16876668. doi:10.1016/S0140-6736(06)69113-7.
- ^ a b c Waring SC, Rosenberg RN (2008). «Genome-wide association studies in Alzheimer disease». Arch Neurol. 65 (3): 329–34. PMID 18332245. doi:10.1001/archneur.65.3.329.
- ^ a b Selkoe DJ (1999). «Translating cell biology into therapeutic advances in Alzheimer's disease». Nature. 399 (6738 Suppl): A23–31. PMID 10392577. doi:10.1038/19866. Siteringsfeil: Ugyldig
<ref>-tagg; navnet «pmid8938131» er definert flere steder med ulikt innhold - ^ Shioi J, Georgakopoulos A, Mehta P; m.fl. (2007). «FAD mutants unable to increase neurotoxic Aβ 42 suggest that mutation effects on neurodegeneration may be independent of effects on Abeta.». J Neurochem. 101 (3): 674–81. PMID 17254019. doi:10.1111/j.1471-4159.2006.04391.x.
- ^ Strittmatter WJ, Saunders AM, Schmechel D; m.fl. (1993). «Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease». Proc. Natl. Acad. Sci. USA. 90 (5): 1977–81. PMC 46003
 . PMID 8446617. doi:10.1073/pnas.90.5.1977.
. PMID 8446617. doi:10.1073/pnas.90.5.1977.
- ^ a b Mahley RW, Weisgraber KH, Huang Y (2006). «Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer's disease». Proc. Natl. Acad. Sci. U.S.A. 103 (15): 5644–51. PMC 1414631
 . PMID 16567625. doi:10.1073/pnas.0600549103.
. PMID 16567625. doi:10.1073/pnas.0600549103.
- ^ Mendez MF (2006). «The accurate diagnosis of early-onset dementia». International Journal of Psychiatry Medicine. 36 (4): 401–412. PMID 17407994. doi:10.2190/Q6J4-R143-P630-KW41.
- ^ Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J (2006). «Therapeutic approaches to Alzheimer's disease». Brain. 129 (Pt 11): 2840–55. PMID 17018549. doi:10.1093/brain/awl280.
- ^ «Dementia: Quick reference guide» (PDF). London: (UK) National Institute for Health and Clinical Excellence. 2006. ISBN 1-84629-312-X. Besøkt 22. februar 2008.
- ^ a b Schroeter ML, Stein T, Maslowski N, Neumann J (2009). «Neural correlates of Alzheimer's disease and mild cognitive impairment – A meta-analysis including 1351 patients.». NeuroImage. 47 (4): 1196–1206. PMC 2730171
 . PMID 19463961. doi:10.1016/j.neuroimage.2009.05.037. Siteringsfeil: Ugyldig
. PMID 19463961. doi:10.1016/j.neuroimage.2009.05.037. Siteringsfeil: Ugyldig <ref>-tagg; navnet «pmid16327345» er definert flere steder med ulikt innhold - ^ a b McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (1984). «Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease». Neurology. 34 (7): 939–44. PMID 6610841.
- ^ a b Dubois B, Feldman HH, Jacova C; m.fl. (2007). «Research criteria for the diagnosis of Alzheimer's disease: revising the NINCDS-ADRDA criteria». Lancet Neurol. 6 (8): 734–46. PMID 17616482. doi:10.1016/S1474-4422(07)70178-3.
- ^ Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (1994). «Reliability and validity of NINCDS-ADRDA criteria for Alzheimer's disease. The National Institute of Mental Health Genetics Initiative». Arch. Neurol. 51 (12): 1198–204. PMID 7986174.
- ^ American Psychiatric Association (2000). Diagnostic and statistical manual of mental disorders: DSM-IV-TR (4th Edition Text Revision utg.). Washington, DC: American Psychiatric Association. ISBN 0890420254.
- ^ Ito N (1996). «[Clinical aspects of dementia]». Hokkaido Igaku Zasshi. 71 (3): 315–20. PMID 8752526.
- ^ Tombaugh TN, McIntyre NJ (1992). «The mini-mental state examination: a comprehensive review». J Am Geriatr Soc. 40 (9): 922–35. PMID 1512391.
- ^ Pasquier F (1999). «Early diagnosis of dementia: neuropsychology». J. Neurol. 246 (1): 6–15. PMID 9987708. doi:10.1007/s004150050299.
- ^ Antoine C, Antoine P, Guermonprez P, Frigard B (2004). «[Awareness of deficits and anosognosia in Alzheimer's disease.]». Encephale. 30 (6): 570–7. PMID 15738860. doi:10.1016/S0013-7006(04)95472-3.
- ^ Cruz VT, Pais J, Teixeira A, Nunes B (2004). «[The initial symptoms of Alzheimer disease: caregiver perception]». Acta Med Port. 17 (6): 435–44. PMID 16197855.
- ^ Marksteiner J, Hinterhuber H, Humpel C (2007). «Cerebrospinal fluid biomarkers for diagnosis of Alzheimer's disease: beta-amyloid(1-42), tau, phospho-tau-181 and total protein». Drugs Today. 43 (6): 423–31. PMID 17612711. doi:10.1358/dot.2007.43.6.1067341.
- ^ a b c De Meyer G, Shapiro F, Vanderstichele H, Vanmechelen E, Engelborghs S, De Deyn PP, Coart E, Hansson O, Minthon L, Zetterberg H, Blennow K, Shaw L, Trojanowski JQ (2010). «Diagnosis-Independent Alzheimer Disease Biomarker Signature in Cognitively Normal Elderly People». Arch Neurol. 67 (8): 949–56. PMID 20697045. doi:10.1001/archneurol.2010.179.
- ^ Kolata G (August 9, 2010). «Spinal-Fluid Test Is Found to Predict Alzheimer's». The New York Times. Besøkt August 10, 2010. Sjekk datoverdier i
|besøksdato=, |dato=(hjelp) - ^ Roan S (August 9, 2010). «Tapping into an accurate diagnosis of Alzheimer's disease». Los Angeles Times. Besøkt August 10, 2010. Sjekk datoverdier i
|besøksdato=, |dato=(hjelp) - ^ Clarfield AM (2003). «The decreasing prevalence of reversible dementias: an updated meta-analysis». Arch. Intern. Med. 163 (18): 2219–29. PMID 14557220. doi:10.1001/archinte.163.18.2219.
- ^ SunSun x, Steffens DC, Au R, X; Steffens, DC; Au, R; Folstein, M; Summergrad, P; Yee, J; Rosenberg, I; Mwamburi, DM; Qiu, WQ; m.fl. (2008). «Amyloid-Associated Depression: A Prodromal Depression of Alzheimer Disease?». Arch Gen Psychiatry. 65 (5): 542–550. PMID 18458206. doi:10.1001/archpsyc.65.5.542.
- ^ Geldmacher DS, Whitehouse PJ (1997). «Differential diagnosis of Alzheimer's disease». Neurology. 48 (5 Suppl 6): S2–9. PMID 9153154.
- ^ Potter GG, Steffens DC (2007). «Contribution of depression to cognitive impairment and dementia in older adults». Neurologist. 13 (3): 105–17. PMID 17495754. doi:10.1097/01.nrl.0000252947.15389.a9.
- ^ Bonte FJ, Harris TS, Hynan LS, Bigio EH, White CL (2006). «Tc-99m HMPAO SPECT in the differential diagnosis of the dementias with histopathologic confirmation». Clin Nucl Med. 31 (7): 376–8. PMID 16785801. doi:10.1097/01.rlu.0000222736.81365.63.
- ^ Dougall NJ, Bruggink S, Ebmeier KP (2004). «Systematic review of the diagnostic accuracy of 99mTc-HMPAO-SPECT in dementia». Am J Geriatr Psychiatry. 12 (6): 554–70. PMID 15545324. doi:10.1176/appi.ajgp.12.6.554.
- ^ Carpenter AP Jr, Pontecorvo MJ, Hefti FF, Skovronsky DM (2009 Aug). «The use of the exploratory IND in the evaluation and development of 18F-PET radiopharmaceuticals for amyloid imaging in the brain: a review of one company's experience». Q J Nucl Med Mol Imaging. 53 (4): 387–93. PMID 19834448. Sjekk datoverdier i
|dato=(hjelp) - ^ Leung K (April 8, 2010). «(E)-4-(2-(6-(2-(2-(2-(18F-fluoroethoxy)ethoxy)ethoxy)pyridin-3-yl)vinyl)-N-methyl benzenamine [[18F]AV-45]». Molecular Imaging and Contrast Agent Database. Besøkt 24. juni 2010. Sjekk datoverdier i
|dato=(hjelp) - ^ Kolata G (June 23, 2010). «Promise Seen for Detection of Alzheimer's». The New York Times. Besøkt June 23, 2010. Sjekk datoverdier i
|besøksdato=, |dato=(hjelp) - ^ a b Wong DF, Rosenberg PB, Zhou Y, Kumar A, Raymont V, Ravert HT, Dannals RF, Nandi A, Brasić JR, Ye W, Hilton J, Lyketsos C, Kung HF, Joshi AD, Skovronsky DM, Pontecorvo MJ (2010 Jun). «In vivo imaging of amyloid deposition in Alzheimer disease using the radioligand 18F-AV-45 (flobetapir F 18)». J Nucl Med. 51 (6): 913–20. PMID 20501908. doi:10.2967/jnumed.109.069088. Sjekk datoverdier i
|dato=(hjelp) - ^ Rabinovici GD, Jagust WJ (2009). «Amyloid imaging in aging and dementia: testing the amyloid hypothesis in vivo». Behav Neurol. 21 (1): 117–28. PMC 2804478
 . PMID 19847050. doi:10.3233/BEN-2009-0232 (inaktiv 2010-08-25).
. PMID 19847050. doi:10.3233/BEN-2009-0232 (inaktiv 2010-08-25).
- ^ O'Brien JT (2007 Dec). «Role of imaging techniques in the diagnosis of dementia». Br J Radiol. 80 (Spec No 2): S71–7. PMID 18445747. doi:10.1259/bjr/33117326. Sjekk datoverdier i
|dato=(hjelp) - ^ Rupsingh R, Borrie M, Smith M, Wells JL, Bartha R (2009). «Reduced hippocampal glutamate in Alzheimer disease». Neurobiol Aging. PMID 19501936. doi:10.1016/j.neurobiolaging.2009.05.002.
- ^ Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD (2008). «Diagnosis and treatment of dementia: 1. Risk assessment and primary prevention of Alzheimer disease». CMAJ. 178 (5): 548–56. PMC 2244657
 . PMID 18299540. doi:10.1503/cmaj.070796.
. PMID 18299540. doi:10.1503/cmaj.070796.
- ^ Rosendorff C, Beeri MS, Silverman JM (2007). «Cardiovascular risk factors for Alzheimer's disease». Am J Geriatr Cardiol. 16 (3): 143–9. PMID 17483665. doi:10.1111/j.1076-7460.2007.06696.x.
- ^ Reiss AB, Wirkowski E (2007). «Role of HMG-CoA reductase inhibitors in neurological disorders: progress to date». Drugs. 67 (15): 2111–20. PMID 17927279. doi:10.2165/00003495-200767150-00001.
- ^ Kuller LH (2007). «Statins and dementia». Curr Atheroscler Rep. 9 (2): 154–61. PMID 17877925. doi:10.1007/s11883-007-0012-9.
- ^ a b Solfrizzi V, Capurso C, D'Introno A; m.fl. (2008). «Lifestyle-related factors in predementia and dementia syndromes». Expert Rev Neurother. 8 (1): 133–58. PMID 18088206. doi:10.1586/14737175.8.1.133.
- ^ Panza F, Capurso C, D'Introno A, Colacicco AM, Frisardi V, Lorusso M, Santamato A, Seripa D, Pilotto A, Scafato E, Vendemiale G, Capurso A, Solfrizzi V. (May 2009). «Alcohol drinking, cognitive functions in older age, predementia, and dementia syndromes». J Alzheimers Dis. 17 (1): 7–31. PMID 19494429. doi:10.3233/JAD-2009-1009 (inaktiv 2010-08-25). Sjekk datoverdier i
|dato=(hjelp) - ^ a b c Boothby LA, Doering PL (2005). «Vitamin C and vitamin E for Alzheimer's disease». Ann Pharmacother. 39 (12): 2073–80. PMID 16227450. doi:10.1345/aph.1E495.
- ^ Isaac MG, Quinn R, Tabet N (2008). «Vitamin E for Alzheimer's disease and mild cognitive impairment». Cochrane Database Syst Rev (3): CD002854. PMID 18646084. doi:10.1002/14651858.CD002854.pub2.
- ^ Malouf R, Grimley Evans J (2008). «Folic acid with or without vitamin B12 for the prevention and treatment of healthy elderly and demented people». Cochrane Database Syst Rev (4): CD004514. PMID 18843658. doi:10.1002/14651858.CD004514.pub2.
- ^ Wald DS, Kasturiratne A, Simmonds M (June 2010). «Effect of folic acid, with or without other B vitamins, on cognitive decline: meta-analysis of randomized trials». The American Journal of Medicine. 123 (6): 522–527.e2. PMID 20569758. doi:10.1016/j.amjmed.2010.01.017. Sjekk datoverdier i
|dato=(hjelp) - ^ a b c Szekely CA, Town T, Zandi PP (2007). «NSAIDs for the chemoprevention of Alzheimer's disease». Subcell Biochem. 42: 229–48. PMID 17612054. doi:10.1007/1-4020-5688-5_11.
- ^ Ringman JM, Frautschy SA, Cole GM, Masterman DL, Cummings JL (2005). «A potential role of the curry spice curcumin in Alzheimer's disease». Curr Alzheimer Res. 2 (2): 131–6. PMC 1702408
 . PMID 15974909. doi:10.2174/1567205053585882.
. PMID 15974909. doi:10.2174/1567205053585882.
- ^ Aggarwal BB, Harikumar KB (2009). «Potential therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary, metabolic, autoimmune and neoplastic diseases». Int J Biochem Cell Biol. 41 (1): 40–59. PMC 2637808
 . PMID 18662800. doi:10.1016/j.biocel.2008.06.010.
. PMID 18662800. doi:10.1016/j.biocel.2008.06.010.
- ^ Farquhar C, Marjoribanks J, Lethaby A, Suckling JA, Lamberts Q (15 April 2009). «Long term hormone therapy for perimenopausal and postmenopausal women». Cochrane Database Syst Rev (2): CD004143. PMID 19370593. doi:10.1002/14651858.CD004143.pub3. Sjekk datoverdier i
|dato=(hjelp) - ^ Barrett-ConnorBarrett-Connor E, Laughlin GA, E; Laughlin, GA (May 2009). «Endogenous and exogenous estrogen, cognitive function, and dementia in postmenopausal women: evidence from epidemiologic studies and clinical trials». Semin Reprod Med. 27 (3): 275–82. PMC 2701737
 . PMID 19401958. doi:10.1055/s-0029-1216280. Sjekk datoverdier i
. PMID 19401958. doi:10.1055/s-0029-1216280. Sjekk datoverdier i |dato=(hjelp) - ^ Birks J, Grimley Evans J (2009). «Ginkgo biloba for cognitive impairment and dementia». Cochrane Database Syst Rev (1): CD003120. PMID 19160216. doi:10.1002/14651858.CD003120.pub3. Besøkt 13. august 2009.
- ^ DeKosky ST, Williamson JD, Fitzpatrick AL; m.fl. (2008). «Ginkgo biloba for Prevention of Dementia». Journal of the American Medical Association. 300 (19): 2253–2262. PMC 2823569
 . PMID 19017911. doi:10.1001/jama.2008.683. Besøkt 18. november 2008.
. PMID 19017911. doi:10.1001/jama.2008.683. Besøkt 18. november 2008.
- ^ Eskelinen MH, Ngandu T, Tuomilehto J, Soininen H, Kivipelto M (2009). «Midlife coffee and tea drinking and the risk of late-life dementia: a population-based CAIDE study». J Alzheimers Dis. 16 (1): 85–91. PMID 19158424. doi:10.3233/JAD-2009-0920 (inaktiv 2010-08-25).
- ^ a b
[utdatert] PMID 16917199 (PMID 16917199)
Denne kilden er ikke fullstendig. Du kan utvide den manuelt - ^ a b Paradise M, Cooper C, Livingston G (2009). «Systematic review of the effect of education on survival in Alzheimer's disease». Int Psychogeriatr. 21 (1): 25–32. PMID 19026089. doi:10.1017/S1041610208008053.
- ^ Shcherbatykh I, Carpenter DO (2007). «The role of metals in the etiology of Alzheimer's disease». J Alzheimers Dis. 11 (2): 191–205. PMID 17522444.
- ^ Rondeau V, Commenges D, Jacqmin-Gadda H, Dartigues JF (2000). «Relation between aluminum concentrations in drinking water and Alzheimer's disease: an 8-year follow-up study». Am J Epidemiol. 152 (1): 59–66. PMC 2215380
 . PMID 10901330. doi:10.1093/aje/152.1.59.
. PMID 10901330. doi:10.1093/aje/152.1.59.
- ^ Kukull WA, Larson EB, Bowen JD; m.fl. (1995). «Solvent exposure as a risk factor for Alzheimer's disease: a case-control study». Am J Epidemiol. 141 (11): 1059–71; discussion 1072–9. PMID 7771442.
- ^ Santibáñez M, Bolumar F, García AM (2007). «Occupational risk factors in Alzheimer's disease: a review assessing the quality of published epidemiological studies». Occupational and Environmental Medicine. 64 (11): 723–732. PMID 17525096. doi:10.1136/oem.2006.028209.
- ^ Seidler A, Geller P, Nienhaus A; m.fl. (2007). «Occupational exposure to low frequency magnetic fields and dementia: a case-control study». Occup Environ Med. 64 (2): 108–14. PMC 2078432
 . PMID 17043077. doi:10.1136/oem.2005.024190.
. PMID 17043077. doi:10.1136/oem.2005.024190.
- ^ Rondeau V (2002). «A review of epidemiologic studies on aluminum and silica in relation to Alzheimer's disease and associated disorders». Rev Environ Health. 17 (2): 107–21. PMID 12222737.
- ^ Martyn CN, Coggon DN, Inskip H, Lacey RF, Young WF (1997). «Aluminum concentrations in drinking water and risk of Alzheimer's disease». Epidemiology. 8 (3): 281–6. PMID 9115023. doi:10.1097/00001648-199705000-00009.
- ^ Graves AB, Rosner D, Echeverria D, Mortimer JA, Larson EB (1998). «Occupational exposures to solvents and aluminium and estimated risk of Alzheimer's disease». Occup Environ Med. 55 (9): 627–33. PMC 1757634
 . PMID 9861186. doi:10.1136/oem.55.9.627.
. PMID 9861186. doi:10.1136/oem.55.9.627.
- ^ Scientific Committee on Emerging and Newly Identified Health Risks-SCENIHR (January 2009). «Health Effects of Exposure to EMF» (PDF). Brussels: Directorate General for Health&Consumers; European Commission: 4–5. Besøkt 27. april 2010. Sjekk datoverdier i
|dato=(hjelp) - ^ Cataldo JK, Prochaska JJ, Glantz SA (2010). «Cigarette smoking is a risk factor for Alzheimer's disease: an analysis controlling for tobacco industry affiliation». J Alzheimers Dis. 19 (2): 465–80. PMID 20110594. doi:10.3233/JAD-2010-1240 (inaktiv 2010-08-25).
- ^ Eikelenboom, P; Van Exel, E; Hoozemans, JJ; Veerhuis, R; Rozemuller, AJ; Van Gool, WA (2010). «Neuroinflammation - an early event in both the history and pathogenesis of Alzheimer's disease.». Neuro-degenerative diseases. 7 (1-3): 38–41. PMID 20160456. doi:10.1159/000283480.
- ^ Geula C, Mesulam MM (1995). «Cholinesterases and the pathology of Alzheimer disease». Alzheimer Dis Assoc Disord. 9 Suppl 2: 23–28. PMID 8534419.
- ^ Stahl SM (2000). «The new cholinesterase inhibitors for Alzheimer's disease, Part 2: illustrating their mechanisms of action». J Clin Psychiatry. 61 (11): 813–814. PMID 11105732. doi:10.4088/JCP.v61n1101.
- ^ «Donepezil». Medline Plus. US National Library of Medicine. 8. januar 2007. Besøkt 3. februar 2010.
- ^ «Galantamine». Medline Plus. US National Library of Medicine. 8. januar 2007. Besøkt 3. februar 2010.
- ^ «Rivastigmine». Medline Plus. US National Library of Medicine. 8. januar 2007. Besøkt 3. februar 2010.
- ^ «Rivastigmine Transdermal». Medline Plus. US National Library of Medicine. 8. januar 2007. Besøkt 3. februar 2010.
- ^ Birks J; Birks, Jacqueline (2006). «Cholinesterase inhibitors for Alzheimer's disease». Cochrane Database Syst Rev (1): CD005593. PMID 16437532. doi:10.1002/14651858.CD005593.
- ^ Birks J, Grimley Evans J, Iakovidou V, Tsolaki M, Holt FE (2009 Apr 15). «Rivastigmine for Alzheimer's disease». Cochrane Database Syst Rev (2): CD001191. PMID 19370562. doi:10.1002/14651858.CD001191.pub2. Sjekk datoverdier i
|dato=(hjelp) - ^ Birks J, Harvey RJ (2006 Jan 25). «Donepezil for dementia due to Alzheimer's disease». Cochrane Database Syst Rev (1): CD001190. PMID 16437430. doi:10.1002/14651858.CD001190.pub2. Sjekk datoverdier i
|dato=(hjelp) - ^ Raschetti R, Albanese E, Vanacore N, Maggini M (2007). «Cholinesterase inhibitors in mild cognitive impairment: a systematic review of randomised trials». PLoS Med. 4 (11): e338. PMC 2082649
 . PMID 18044984. doi:10.1371/journal.pmed.0040338.
. PMID 18044984. doi:10.1371/journal.pmed.0040338.
- ^ «Memantine». US National Library of Medicine (Medline). 4. januar 2004. Besøkt 3. februar 2010.
- ^ Siteringsfeil: Ugyldig
<ref>-tagg; ingen tekst ble oppgitt for referansen ved navnpmid16424917 - ^ Areosa Sastre A, McShane R, Sherriff F (2004). «Memantine for dementia». Cochrane Database Syst Rev (4): CD003154. PMID 15495043. doi:10.1002/14651858.CD003154.pub2.
- ^ «Namenda Prescribing Information» (PDF). Forest Pharmaceuticals. Besøkt 19. februar 2008. (primærkilden)
- ^ Raina P, Santaguida P, Ismaila A; m.fl. (2008). «Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline». Annals of Internal Medicine. 148 (5): 379–397. PMID 18316756.
- ^ Siteringsfeil: Ugyldig
<ref>-tagg; ingen tekst ble oppgitt for referansen ved navnpmid19138567 - ^ Eubanks LM, Rogers CJ, Beuscher AE; m.fl. (2006). «A molecular link between the active component of marijuana and Alzheimer's disease pathology» (Free full text). Molecular Pharmaceutics. 3 (6): 773–7. PMC 2562334
 . PMID 17140265. doi:10.1021/mp060066m.
. PMID 17140265. doi:10.1021/mp060066m.
- ^ Campbell VA, Gowran A (2007 November). «Alzheimer's disease; taking the edge off with cannabinoids?». Br J Pharmacol. 152 (5): 655–62. PMC 2190031
 . PMID 17828287. doi:10.1038/sj.bjp.0707446. Sjekk datoverdier i
. PMID 17828287. doi:10.1038/sj.bjp.0707446. Sjekk datoverdier i |dato=(hjelp) - ^ a b c d e f g «Practice Guideline for the Treatment of Patients with Alzheimer's disease and Other Dementias» (PDF). American Psychiatric Association. 2007. doi:10.1176/appi.books.9780890423967.152139. Besøkt 28. desember 2007.
- ^ Bottino CM, Carvalho IA, Alvarez AM; m.fl. (2005). «Cognitive rehabilitation combined with drug treatment in Alzheimer's disease patients: a pilot study». Clin Rehabil. 19 (8): 861–869. PMID 16323385. doi:10.1191/0269215505cr911oa.
- ^ Doody RS, Stevens JC, Beck C; m.fl. (2001). «Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology». Neurology. 56 (9): 1154–1166. PMID 11342679.
- ^ Hermans DG, Htay UH, McShane R (2007). «Non-pharmacological interventions for wandering of people with dementia in the domestic setting». Cochrane Database Syst Rev (1): CD005994. PMID 17253573. doi:10.1002/14651858.CD005994.pub2.
- ^ Robinson L, Hutchings D, Dickinson HO; m.fl. (2007). «Effectiveness and acceptability of non-pharmacological interventions to reduce wandering in dementia: a systematic review». Int J Geriatr Psychiatry. 22 (1): 9–22. PMID 17096455. doi:10.1002/gps.1643.
- ^ Woods B, Spector A, Jones C, Orrell M, Davies S (2005). «Reminiscence therapy for dementia». Cochrane Database Syst Rev (2): CD001120. PMID 15846613. doi:10.1002/14651858.CD001120.pub2.
- ^ Zetteler J (2008). «Effectiveness of simulated presence therapy for individuals with dementia: a systematic review and meta-analysis». Aging Ment Health. 12 (6): 779–85. PMID 19023729. doi:10.1080/13607860802380631.
- ^ Neal M, Briggs M (2003). «Validation therapy for dementia». Cochrane Database Syst Rev (3): CD001394. PMID 12917907. doi:10.1002/14651858.CD001394.
- ^ Chung JC, Lai CK, Chung PM, French HP (2002). «Snoezelen for dementia». Cochrane Database Syst Rev (4): CD003152. PMID 12519587. doi:10.1002/14651858.CD003152.
- ^ Spector A, Orrell M, Davies S, Woods B (2000). «Withdrawn: Reality orientation for dementia». Cochrane Database Syst Rev (3): CD001119. PMID 17636652. doi:10.1002/14651858.CD001119.pub2.
- ^ Spector A, Thorgrimsen L, Woods B; m.fl. (2003). «Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia: randomised controlled trial». Br J Psychiatry. 183: 248–254. PMID 12948999. doi:10.1192/bjp.183.3.248.
- ^ Gitlin LN, Corcoran M, Winter L, Boyce A, Hauck WW (1 February 2001). «A randomized, controlled trial of a home environmental intervention: effect on efficacy and upset in caregivers and on daily function of persons with dementia». Gerontologist. 41 (1): 4–14. PMID 11220813. Besøkt 15. juli 2008. Sjekk datoverdier i
|dato=(hjelp) - ^ Gitlin LN, Hauck WW, Dennis MP, Winter L (2005). «Maintenance of effects of the home environmental skill-building program for family caregivers and individuals with Alzheimer's disease and related disorders». J. Gerontol. A Biol. Sci. Med. Sci. 60 (3): 368–74. PMID 15860476.
- ^ «Treating behavioral and psychiatric symptoms». Alzheimer's Association. 2006. Besøkt 25. september 2006.
- ^ Dunne TE, Neargarder SA, Cipolloni PB, Cronin-Golomb A (2004). «Visual contrast enhances food and liquid intake in advanced Alzheimer's disease». Clinical Nutrition. 23 (4): 533–538. PMID 15297089. doi:10.1016/j.clnu.2003.09.015.
- ^ Dudek, Susan G. (2007). Nutrition essentials for nursing practice. Hagerstown, Maryland: Lippincott Williams & Wilkins. s. 360. ISBN 0-7817-6651-6. Besøkt 19. august 2008.
- ^ Dennehy C (2006). «Analysis of patients' rights: dementia and PEG insertion». Br J Nurs. 15 (1): 18–20. PMID 16415742.
- ^ Chernoff R (2006). «Tube feeding patients with dementia». Nutr Clin Pract. 21 (2): 142–6. PMID 16556924. doi:10.1177/0115426506021002142.
- ^ Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R (1999). «Predictors of mortality in patients with Alzheimer's disease living in nursing homes». J. Neurol. Neurosurg. Psychiatr. 67 (1): 59–65. PMC 1736445
 . PMID 10369823. doi:10.1136/jnnp.67.1.59.
. PMID 10369823. doi:10.1136/jnnp.67.1.59.
- ^ Mitchell SL, Teno JM, Kiely DK; m.fl. (2009). «The clinical course of advanced dementia». N Engl J Med. 361 (16): 1529–38. PMC 2778850
 . PMID 19828530. doi:10.1056/NEJMoa0902234.
. PMID 19828530. doi:10.1056/NEJMoa0902234.
- ^ a b Bowen JD, Malter AD, Sheppard L; m.fl. (1996). «Predictors of mortality in patients diagnosed with probable Alzheimer's disease». Neurology. 47 (2): 433–9. PMID 8757016.
- ^ a b Dodge HH, Shen C, Pandav R, DeKosky ST, Ganguli M (2003). «Functional transitions and active life expectancy associated with Alzheimer disease». Arch. Neurol. 60 (2): 253–9. PMID 12580712. doi:10.1001/archneur.60.2.253.
- ^ Larson EB, Shadlen MF, Wang L; m.fl. (2004). «Survival after initial diagnosis of Alzheimer disease». Ann. Intern. Med. 140 (7): 501–9. PMID 15068977.
- ^ Jagger C, Clarke M, Stone A (1995). «Predictors of survival with Alzheimer's disease: a community-based study». Psychol Med. 25 (1): 171–7. PMID 7792352. doi:10.1017/S0033291700028191.
- ^ a b Ganguli M, Dodge HH, Shen C, Pandav RS, DeKosky ST (2005). «Alzheimer disease and mortality: a 15-year epidemiological study». Arch. Neurol. 62 (5): 779–84. PMID 15883266. doi:10.1001/archneur.62.5.779.
- ^ a b c Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (2008). «Incidence and subtypes of dementia in three elderly populations of central Spain». J. Neurol. Sci. 264 (1–2): 63–72. PMID 17727890. doi:10.1016/j.jns.2007.07.021.
- ^ a b c Di Carlo A, Baldereschi M, Amaducci L; m.fl. (2002). «Incidence of dementia, Alzheimer's disease, and vascular dementia in Italy. The ILSA Study». J Am Geriatr Soc. 50 (1): 41–8. PMID 12028245. doi:10.1046/j.1532-5415.2002.50006.x.
- ^ Andersen K, Launer LJ, Dewey ME; m.fl. (1999). «Gender differences in the incidence of AD and vascular dementia: The EURODEM Studies. EURODEM Incidence Research Group». Neurology. 53 (9): 1992–7. PMID 10599770.
- ^ World Health Organization (2006). Neurological Disorders: Public Health Challenges. Switzerland: World Health Organization. s. 204–207. ISBN 978-92-4-156336-9.
- ^ Ferri CP, Prince M, Brayne C; m.fl. (2005). «Global prevalence of dementia: a Delphi consensus study» (PDF). Lancet. 366 (9503): 2112–7. PMC 2850264
 . PMID 16360788. doi:10.1016/S0140-6736(05)67889-0. Besøkt 25. juni 2008.
. PMID 16360788. doi:10.1016/S0140-6736(05)67889-0. Besøkt 25. juni 2008.
- ^ Berrios G E (1990). «Alzheimer's disease: a conceptual history». Int. J. Ger. Psychiatry. 5: 355–365. doi:10.1002/gps.930050603.
- ^ Kraepelin Emil, Diefendorf A. Ross (translated by) (17. januar 2007). Clinical Psychiatry: A Textbook For Students And Physicians (Reprint). Kessinger Publishing. s. 568. ISBN 1-4325-0833-4.
- ^ Katzman Robert, Terry Robert D, Bick Katherine L (editors) (1978). Alzheimer's disease: senile dementia and related disorders. New York: Raven Press. s. 595. ISBN 0-89004-225-X.
- ^ Boller F, Forbes MM (1998). «History of dementia and dementia in history: an overview». J. Neurol. Sci. 158 (2): 125–33. PMID 9702682. doi:10.1016/S0022-510X(98)00128-2.
- ^ Amaducci LA, Rocca WA, Schoenberg BS (1986). «Origin of the distinction between Alzheimer's disease and senile dementia: how history can clarify nosology». Neurology. 36 (11): 1497–9. PMID 3531918.
- ^ Allegri RF, Butman J, Arizaga RL; m.fl. (2007). «Economic impact of dementia in developing countries: an evaluation of costs of Alzheimer-type dementia in Argentina». Int Psychogeriatr. 19 (4): 705–18. PMID 16870037. doi:10.1017/S1041610206003784.
- ^ Suh GH, Knapp M, Kang CJ (2006). «The economic costs of dementia in Korea, 2002». Int J Geriatr Psychiatry. 21 (8): 722–8. PMID 16858741. doi:10.1002/gps.1552.
- ^ Wimo A, Jonsson L, Winblad B (2006). «An estimate of the worldwide prevalence and direct costs of dementia in 2003». Dement Geriatr Cogn Disord. 21 (3): 175–81. PMID 16401889. doi:10.1159/000090733.
- ^ a b c Moore MJ, Zhu CW, Clipp EC (2001). «Informal costs of dementia care: estimates from the National Longitudinal Caregiver Study». J Gerontol B Psychol Sci Soc Sci. 56 (4): S219–28. PMID 11445614.
- ^ Jönsson L, Eriksdotter Jönhagen M, Kilander L; m.fl. (2006). «Determinants of costs of care for patients with Alzheimer's disease». Int J Geriatr Psychiatry. 21 (5): 449–59. PMID 16676288. doi:10.1002/gps.1489.
- ^ a b Zhu CW, Sano M (2006). «Economic considerations in the management of Alzheimer's disease». Clin Interv Aging. 1 (2): 143–54. PMC 2695165
 . PMID 18044111. doi:10.2147/ciia.2006.1.2.143.
. PMID 18044111. doi:10.2147/ciia.2006.1.2.143.
- ^ Gaugler JE, Kane RL, Kane RA, Newcomer R (2005). «Early community-based service utilization and its effects on institutionalization in dementia caregiving». Gerontologist. 45 (2): 177–85. PMID 15799982.
- ^ Ritchie K, Lovestone S (2002). «The dementias». Lancet. 360 (9347): 1759–66. PMID 12480441. doi:10.1016/S0140-6736(02)11667-9.
- ^ Brodaty H, Hadzi-Pavlovic D (1990). «Psychosocial effects on carers of living with persons with dementia». Aust N Z J Psychiatry. 24 (3): 351–61. PMID 2241719. doi:10.3109/00048679009077702.
- ^ Donaldson C, Tarrier N, Burns A (1998). «Determinants of carer stress in Alzheimer's disease». Int J Geriatr Psychiatry. 13 (4): 248–56. PMID 9646153. doi:10.1002/(SICI)1099-1166(199804)13:4<248::AID-GPS770>3.0.CO;2-0.
- ^ [død lenke] «The MetLife Study of Alzheimer's Disease: The Caregiving Experience» (PDF). MetLife Mature Market Institute. 2006. Besøkt 12. februar 2008.
- ^ Pusey H, Richards D (2001). «A systematic review of the effectiveness of psychosocial interventions for carers of people with dementia». Aging Ment Health. 5 (2): 107–19. PMID 11511058. doi:10.1080/13607860120038302.
- ^ Garrard P, Maloney LM, Hodges JR, Patterson K (2005). «The effects of very early Alzheimer's disease on the characteristics of writing by a renowned author». Brain. 128 (Pt 2): 250–60. PMID 15574466. doi:10.1093/brain/awh341. Ekstern lenke i
|title=(hjelp) - ^ Sherman FT (2004). «Did President Reagan have mild cognitive impairment while in office? Living longer with Alzheimer's Disease». Geriatrics. 59 (9): 11, 15. PMID 15461232. Ekstern lenke i
|title=(hjelp) - ^ Venneri A, Forbes-Mckay KE, Shanks MF (2005). «Impoverishment of spontaneous language and the prediction of Alzheimer's disease». Brain. 128 (Pt 4): E27. PMID 15788549. doi:10.1093/brain/awh419.
- ^ «Hungary legend Puskas dies at 79». BBC News. 17. november 2006. Besøkt 25. januar 2008.
- ^ «Prime Ministers in History: Harold Wilson». London: 10 Downing Street. Besøkt 18. august 2008.
- ^ «Mi padre no reconoció al Rey pero notó el cariño». Madrid: El País. 2008. Besøkt 1. oktober 2008.
- ^ «Chicago Rita Hayworth Gala». Alzheimer's Association. 2007. Besøkt 3. februar 2010.
- ^ «Charlton Heston has Alzheimer's symptoms». CNN. 9. august 2002. Besøkt 25. januar 2008.
- ^ «Nobel Prize Winner has Alzheimer's». The Straits Times. 8. oktober 2009. Besøkt 9. oktober 2009.
- ^ «Iris». IMDB. 18. januar 2002. Besøkt 24. januar 2008.
- ^ Bayley John (2000). Iris: a memoir of Iris Murdoch. London: Abacus. ISBN 9780349112152. OCLC 41960006.
- ^ «The notebook». IMDB. Besøkt 22. februar 2008.
- ^ Sparks Nicholas (1996). The notebook. Thorndike, Maine: Thorndike Press. s. 268. ISBN 078620821X.
- ^ «Thanmathra». Webindia123.com. Besøkt 24. januar 2008.
- ^ «Ashita no kioku». IMDB. Besøkt 24. januar 2008.
- ^ Ogiwara Hiroshi (2004). Ashita no Kioku (Mal:Jp icon). Tōkyō: Kōbunsha. ISBN 9784334924461. OCLC 57352130.
- ^ Munro Alice (2001). [The bear came over the mountain The bear came over the mountain] Sjekk
|kapittelurl=-verdien (hjelp)|kapittelurl=mangler tittel (hjelp). Hateship, Friendship, Courtship, Loveship, Marriage: Stories. New York: A.A. Knopf. ISBN 9780375413001. OCLC 46929223. - ^ Lashuel HA, Hartley DM, Balakhaneh D, Aggarwal A, Teichberg S, Callaway DJE (2002). «New class of inhibitors of [[Beta amyloid|amyloid-beta]] fibril formation. Implications for the mechanism of pathogenesis in Alzheimer's disease». J Biol Chem. 277 (45): 42881–42890. PMID 12167652. doi:10.1074/jbc.M206593200. URL-wikilenke-konflikt (hjelp)
- ^ Dodel r, Neff F, Noelker C, Pul R, Du Y, Bacher M Oertel W. (2010). «Intravenous Immunoglobulins as a Treatment for Alzheimer's Disease: Rationale and Current Evidence». Drugs. 70 (5): 513–528. PMID 20329802. doi:10.2165/11533070-000000000-00000.
- ^ «Study Evaluating Safety, Tolerability, and Immunogenicity of ACC-001 in Subjects With Alzheimer's Disease». US National Institutes of Health. Besøkt 5. juni 2008.
- ^ «Alzheimer's Disease Vaccine Trial Suspended on Safety Concern». Medpage Today. 18. april 2008. Besøkt 14. juni 2008.
- ^ «Bapineuzumab in Patients With Mild to Moderate Alzheimer's Disease/ Apo_e4 non-carriers». Clinical Trial. US National Institutes of Health. 29. februar 2008. Besøkt 23. mars 2008.
- ^ «Safety, Tolerability and Efficacy Study to Evaluate Subjects With Mild Cognitive Impairment». Clinical Trial. US National Institutes of Health. 11. mars 2008. Besøkt 23. mars 2008.
- ^ «Study Evaluating the Safety, Tolerability and Efficacy of PBT2 in Patients With Early Alzheimer's Disease». Clinical Trial. US National Institutes of Health. 13. januar 2008. Besøkt 23. mars 2008.
- ^ [635] ^ Etanercept research:
- Tobinick E, Gross H, Weinberger A, Cohen H (2006). «TNF-alpha modulation for treatment of Alzheimer's disease: a 6-month pilot study». MedGenMed. 8 (2): 25. PMC 1785182
 . PMID 16926764.
. PMID 16926764. - Griffin WS (2008). «Perispinal etanercept: potential as an Alzheimer therapeutic». J Neuroinflammation. 5: 3. PMC 2241592
 . PMID 18186919. doi:10.1186/1742-2094-5-3.
. PMID 18186919. doi:10.1186/1742-2094-5-3. - Tobinick E (2007). «Perispinal etanercept for treatment of Alzheimer's disease». Curr Alzheimer Res. 4 (5): 550–2. PMID 18220520. doi:10.2174/156720507783018217.
- Tobinick E, Gross H, Weinberger A, Cohen H (2006). «TNF-alpha modulation for treatment of Alzheimer's disease: a 6-month pilot study». MedGenMed. 8 (2): 25. PMC 1785182
- ^ Wischik Claude M, Bentham Peter, Wischik Damon J, Seng Kwang Meng (2008). «Tau aggregation inhibitor (TAI) therapy with remberTM arrests disease progression in mild and moderate Alzheimer's disease over 50 weeks». Alzheimer's & Dementia. Alzheimer's Association. 4 (4): T167. doi:10.1016/j.jalz.2008.05.438. Besøkt 30. juli 2008.
- ^ Harrington Charles, Rickard Janet E, Horsley David; m.fl. (2008). «Methylthioninium chloride (MTC) acts as a Tau aggregation inhibitor (TAI) in a cellular model and reverses Tau pathology in transgenic mouse models of Alzheimer's disease». Alzheimer's & Dementia. Alzheimer's Association. 4: T120–T121. doi:10.1016/j.jalz.2008.05.259.
- ^ Doody RS, Gavrilova SI, Sano M; m.fl. (2008). «Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer's disease: a randomised, double-blind, placebo-controlled study». Lancet. 372 (9634): 207–15. PMID 18640457. doi:10.1016/S0140-6736(08)61074-0.
- ^ [642] ^ Dimebon Disappoints in Phase 3 Trial
- ^ Wozniak M, Mee A, Itzhaki R (2008). «Herpes simplex virus type 1 DNA is located within Alzheimer's disease amyloid plaques». J Pathol. 217 (1): 131–138. PMID 18973185. doi:10.1002/path.2449.
- ^ Newberg, AB; Wintering, N; Khalsa, DS; Roggenkamp, H; Waldman, MR (2010). «Meditation effects on cognitive function and cerebral blood flow in subjects with memory loss: a preliminary study». Journal of Alzheimer's Disease. 20 (2): 517–26. PMID 20164557. doi:10.3233/JAD-2010-1391 (inaktiv 2010-08-25). (primærkilden)
Anbefalt lesing
- Alzheimer's Disease: Unraveling the Mystery. US Department of Health and Human Services, National Institute on Aging, NIH. 2008.
- Can Alzheimer's Disease Be Prevented?. US Department of Health and Human Services, National Institute on Aging, NIH. 2009.
- Caring for a Person with Alzheimer's Disease: Your Easy-to-Use Guide from the National Institute on Aging. US Department of Health and Human Services, National Institute on Aging, NIH. 2009.
- Cummings JL, Frank JC, Cherry D, Kohatsu ND, Kemp B, Hewett L, Mittman B (2002). «Guidelines for managing Alzheimer's disease: Part I. Assessment». American Family Physician. 65 (11): 2263–2272. PMID 12074525.
- Cummings JL, Frank JC, Cherry D, Kohatsu ND, Kemp B, Hewett L, Mittman B (2002). «Guidelines for managing Alzheimer's disease: Part II. Treatment». American Family Physician. 65 (12): 2525–2534. PMID 12086242.
- Russell D, Barston S, White M (19. desember 2007). «Alzheimer's Behavior Management: Learn to manage common behavior problems». helpguide.org. Besøkt 29. februar 2008.
Eksterne lenker
- [http://www.nasjonalforeningen.no/no/Demens/Kontakt_Demenslinjen/ Demenslinjen 81533032
- Helsebibliotekets sider om alderspsykiatri
- Skåringsverktøy (tester) for demens hos Helsebiblioteket
- Alzheimer's Disease Center (ADCs)
- Alzheimer's Disease Education and Referral (ADEAR) Center
- Alzheimer's Association
- UCSF Memory and Aging Center
(en) Alzheimer's disease – kategori av bilder, video eller lyd på Commons
Mal:Mental and behavioral disorders Mal:Diseases of the nervous system Mal:Amyloidosis
