Periodesystemet

Periodesystemet, også kalt periodetabellen eller det periodiske system, er en tabell som klassifiserer grunnstoffene (eller elementene) i perioder. Hver periode består av grunnstoffer med det samme antallet elektronskall rundt atomkjernen. Offisielt opererer man i dag med syv perioder; periode 8 er foreslått, men er foreløpig[når?] ikke anerkjent av den internasjonale kjemi-organisasjonen International Union of Pure and Applied Chemistry (IUPAC).
I antikken var den utbredte oppfatningen at all materie besto av fire grunnelementer: jord, luft, ild og vann. På 1700-tallet ble stadig nye grunnstoffer oppdaget, og teorien om fire grunnelementer ble forkastet. Flere forsøk ble gjort på å systematisere grunnstoffene i en tabell. Ingen lyktes før den russiske kjemiprofessoren Dmitrij Ivanovitsj Mendelejev i 1869 utarbeidet det første utkastet til periodesystemet ved å organisere grunnstoffene etter atomvekt og kjemiske egenskaper. Den første versjonen ligner ikke så mye på dagens periodesystem, men den grunnleggende utformingen er fortsatt den samme.
Dagens periodesystem sorterer grunnstoffene etter antall protoner i atomkjernen (atomnummer) i stedet for atomvekt slik Mendelejevs tabell gjorde. Periodesystemets grupper sorteres etter antall elektroner i ytterste elektronskall, og periodene etter antall elektronskall rundt kjernen. Lantanoidene og actinoidene er metaller som tilhører henholdsvis periode 6 og 7, selv om de vanligvis plasseres for seg selv under tabellen.
FN erklærte 2019 som Det internasjonale året for Periodesystemet», i anledning 150-årsjubileet for «en av vitenskapens vesentligste bragder».[1]
Periodesystemet i tabellform
[rediger | rediger kilde]- Ved å la musepekeren hvile i et av tabellens felter, vil tilleggsinformasjon om det aktuelle grunnstoffet vises. Masse er oppgitt i atommasseenheten u, smeltepunktet i grader celsius, og elektronegativiteten etter Pauling-skalaen.
| Gruppe → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Tidligere →[2] | I A | II A | III A | IV A | V A | VI A | VII A | VIII A | VIII A | VIII A | I B | II B | III B | IV B | V B | VI B | VII B | VIII B |
| ↓ Periode 1 |
1 |
2 | ||||||||||||||||
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | ||||||||||
| 3 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 | ||||||||||
| 4 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
| 5 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
| 6 |
55 |
56 |
57‑71 * |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
| 7 |
87 |
88 |
89‑103 ** |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
111 |
112 |
113 |
114 |
115 |
116 |
117 |
118 |
| * Lantanoider |
57 |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 | |||
| ** Actinoider |
89 |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 | |||
| Alkalimetaller | Jordalkalimetaller | Lantanoider | Actinoider | Transisjonsmetaller |
| Metaller | Halvmetaller | Ikke-metaller | Halogener | Edelgasser |
| (Lantanoidene og aktinoidene er metaller. Halogenene og edelgassene er ikke-metaller.) | ||||
Oppbygging
[rediger | rediger kilde]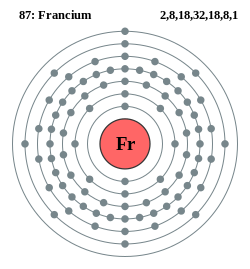
Tabellen er organisert etter antall protoner i atomkjernen (atomnummer), antall elektronskall rundt kjernen (periode), og antall elektroner i ytterste elektronskall (gruppe). Grunnstoffene klassifiseres også i kjemiske serier etter sine kjemiske egenskaper, for eksempel metaller, halogener, edelgasser og så videre. I tillegg deles tabellen opp i blokker basert på elektronkonfigurasjonen. Disse blokkene betegnes med bokstaver: s-blokken, p-blokken, d-blokken og f-blokken. Alle grunnstoff har navn. Navnene har også en forkortelse bestående av én eller to bokstaver kalt kjemisk symbol (unntaket er de midlertidige navnene som har tre bokstaver i forkortelsen). I tabellens enkleste form vises grunnstoffene kun med kjemisk symbol og atomnummer. I mer detaljerte tabeller vises også stoffets fulle navn, atommasse, indikasjon av stofftilstanden ved romtemperatur (fast form, væske eller gass) og så videre. Dagens periodiske system består av syv perioder (118 grunnstoffer). Tabellens utseende har forandret seg flere ganger opp gjennom tiden, men utformingen med lantanoider og aktinoider plassert for seg selv under resten av tabellen, er den mest vanlige i dag.
Atomnummer
[rediger | rediger kilde]Utdypende artikkel: Atomnummer
Atomnummeret er identisk med antall protoner i atomets kjerne (må ikke forveksles med massetall som er det totale antall protoner og nøytroner i kjernen). Antall nøytroner i kjernen kan variere (isotoper), mens antall protoner er unikt for hvert grunnstoff. Dersom et atom mister eller får tilført protoner, går det over til å bli et annet grunnstoff. Ved radioaktiv nedbrytning (for eksempel alfahenfall eller spontan fisjon) vil antall protoner reduseres i kjernen og resultere i et eller flere lettere grunnstoff.
Atommasse
[rediger | rediger kilde]Utdypende artikkel: Atommasse
Antall protoner og nøytroner avgjør atommassen, og forskjellige isotoper har forskjellig atommasse. Angivelse av atommassen er derfor gitt som et gjennomsnitt av naturlig forekommende (stabile) isotoper. For grunnstoff som ikke har noen stabile isotoper blir atommassen til den mest stabile isotopen oppgitt. Enheten u er relativ atommasse og er definert som en tolvtedel av massen til et atom 12C (karbon) i sin grunntilstand.[3] I notasjon blir massetallet (det totale antall kjernepartikler) angitt av et tall oppe til venstre for det kjemiske symbolet. I tilfellet 12C betyr det at kjernen har 6 protoner (siden det er karbon) og 6 nøytroner. En annen måte er å angi massetallet etter grunnstoffnavnet eller det kjemiske symbolet (uran-235 eller U-235). Det er bare de minste atomkjernene som har likt antall protoner og nøytroner; større atomkjernerer inneholder flere nøytroner enn protoner. Uran som har atomnummer 92 (og dermed 92 protoner), har 146 nøytroner i den vanligst forekommende isotopen 238U.[4]

Perioder
[rediger | rediger kilde]Utdypende artikkel: Periodesystemets perioder
Periodene er de vannrette radene i tabellen, og de refererer til antall elektronskall i atomet. Elektronskallene kalles fra innerst og utover K, L ,M , N, O, P, og Q eller 1, 2, 3, 4, 5, 6 og 7. De deles også opp i underskall som igjen består av orbitaler. Hvert elektronskall (og dets underskall) har «plass» til et bestemt antall elektroner. Dagens periodesystem består av 7 perioder. I 1985 ble forsøk på å fremstille grunnstoff 119 utført ved Berkeley-universitetet i California.[5] Forsøket mislyktes, men dersom fremstilling av grunnstoff med høyere atomnummer enn 118 skulle lykkes, må periodesystemet utvides med periode 8.
Grupper
[rediger | rediger kilde]Periodesystemets grupper utgjøres av kolonnene der grunnstoffene står vertikalt plassert i forhold til hverandre. Mendelejevs gruppeinndeling var basert på stoffenes kjemiske egenskaper (som reaktivitet). Dagens gruppe-klassifisering baserer seg på antall elektroner i ytterste skall (valenselektroner), noe som har nøye sammenheng med de kjemiske egenskapene Mendelejev observerte. Gruppe 1 (unntatt hydrogen) kalles alkalimetaller og er plassert helt til venstre i tabellen. Disse stoffene har kun ett valenselektron, og er meget reaktive (reaksjonsvillige). De binder seg svært lett med andre grunnstoff, og finnes derfor ikke i ren form naturlig. Alkalimetallenes rake motsetning er edelgassene som utgjør gruppe 18. Hos edelgassene er det ytterste elektronskallet fullt, noe som gjør at de er ekstremt lite reaktive. De danner derfor ikke kjemiske forbindelser naturlig (edelgass-forbindelser har imidlertid vært kunstig fremstilt i laboratorier).
Elektronegativitet
[rediger | rediger kilde]
Utdypende artikkel: Elektronegativitet
Elektronegativitet er et mål på atomets evne til å trekke til seg felles elektroner i en kjemisk forbindelse. Begrepet ble innført av den amerikanske kjemikeren Linus Pauling, og skalaen har fått navn etter ham. Tallet er et relativt tall, og tar utgangspunkt i verdien 4 for fluor (som er det mest elektronegative grunnstoffet). Elektronegativiteten er lavest i gruppe 1 (alkalimetallene) og stiger ved høyere gruppenummer. De mest elektronegative grunnstoffene tilhører gruppe 17 (halogenene). Tallet er et viktig hjelpemiddel til å forstå og forutse kjemiske bindinger og reaksjoner mellom de forskjellige grunnstoffene.
Nummerering
[rediger | rediger kilde]Gruppene deles gjerne inn i 8 hovedgrupper som angir antall valenselektroner fra 1 til 8 (i tidligere tider benevnt I – VIII), og 10 undergrupper (tidligere benevnt med romertall etterfulgt av bokstaven A eller B). I dagens nummereringssystem tilsvarer hovedgruppene gruppe 1, 2, og 13 – 18, og undergruppene tilsvarer 3 – 12.
Frem til 1988 eksisterte det to forskjellige nummereringssystem for periodesystemets grupper, en amerikansk og en europeisk. Begge benyttet romertall i kombinasjon med bokstavene A og B. Problemet var at bokstavene var brukt forskjellig, noe som gjorde at misforståelser lett kunne oppstå (se tabell under). Siden begynnelsen av 1980-tallet hadde IUPAC forsøkt å finne en løsning på problemet før de skulle gi ut sin navnekonvensjon Nomenclature of Inorganic Chemistry (Part I ) i 1988. IUPAC sendte i 1985 ut et høringsforslag om å gå over til tall i stedet for romertall og bokstaver. Som ventet kom det protester, men på tross av motstanden valgte IUPAC i 1988 å gi ut navnekonvensjonen med en anbefaling om å ta i bruk det nye nummer-systemet.[6] I dag er gruppenummerering med tall i bruk i hele verden.
| Sammenligning av nummereringssystemene før 1988 og i dag | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| System | Gruppe | |||||||||||||||||
| Nåværende | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Amerikansk | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A |
| Europeisk | I A | II A | III A | IV A | V A | VI A | VII A | VIII A | VIII A | VIII A | I B | II B | III B | IV B | V B | VI B | VII B | VIII B |
Kjemiske serier
[rediger | rediger kilde]Kjemiske serier er grupper av grunnstoff som har lignende kjemiske og fysiske egenskaper, og der visse egenskaper endrer seg systematisk gjennom serien. Noen av de kjemiske seriene sammenfaller med periodesystemets grupper, mens andre spenner over flere grupper. De 10 kjemiske seriene blir i periodesystemet uthevet ved hjelp forskjellige farger, og omfatter: alkalimetaller, jordalkalimetaller, lantanoider, aktinoider, transisjonsmetaller, metaller, halvmetaller, ikke-metaller, halogener og edelgasser.
Blokker
[rediger | rediger kilde]Utdypende artikkel: Blokkene i periodesystemet
Grunnstoffene i periodesystemet blir også plassert i blokker basert på elektronkonfigurasjonen. Blokkene beskriver fyllingen av elektronskallenes orbitaler, og angis med bokstavene s, p, d, og f. Utvidelsene av periodesystemet som ble foreslått av Glenn T. Seaborg, vil innebære en ny blokk. Denne blokken (og utvidelsen) er ikke formalisert eller normert av IUPAC, men kalles uoffisielt for g-blokken. Tabellen under viser blokkene markert med farger, inkludert den foreslåtte utvidelsen med periode 8 og g-blokken.
Grunnstoffenes forekomst
[rediger | rediger kilde]Det mest vanlige grunnstoffet i jordskorpen er oksygen, fulgt av silisium. Nesten 99 % av Jordens atmosfære består av grunnstoffene nitrogen og oksygen, hvorav nitrogen utgjør brorparten med over 78 %. I hele jordkloden sett under ett, er jern det vanligste grunnstoffet med 34,6 %, fulgt av oksygen med 29,5 %.[7] På Solen og i universet er det imidlertid hydrogen og helium som er de vanligste grunnstoffene, der hydrogen utgjør 73-75 % og helium 23-24 %. I tabellen under vises noen av de mest vanlige grunnstoffene og forekomsten deres (tabellen er sortérbar).

| Grunnstoff | Atom- nummer |
I universet (%) |
På Solen[9] (%) |
I jordskorpen (%) |
I atmosfæren (%) |
I havet (µg / liter) |
I et menneske (70 kg) (gram) |
|---|---|---|---|---|---|---|---|
| Hydrogen | 1 | 73,9 | 75 | 0,14 | 0,000053 | 110 000 000 | 7 000 |
| Helium | 2 | 24 | 23 | 0,000001 | 0,00052 | 0,0072 | 0 |
| Oksygen | 8 | 1,07 | 0,9 | 46,4 | 20,8 | 880 000 000 | 43 000 |
| Karbon | 6 | 0,46 | 0,3 | 0,02 | 0,0337 | 28 000 | 16 000 |
| Neon | 10 | 0,134 | 0,1 | 0,0000005 | 0,0018 | 0,12 | 0 |
| Jern | 26 | 0,109 | 0,1 | 5,8 | 0 | 3,4 | 4,2 |
| Nitrogen | 7 | 0,097 | 0,1 | 0,002 | 78,05 | 16 000 | 1 800 |
| Silisium | 14 | 0,065 | 0,09 | 27 | 0 | 2 900 | 3 |
| Magnesium | 12 | 0,058 | 0,07 | 2,8 | 0 | 1 300 000 | 19 |
| Svovel | 16 | 0,044 | 0,04 | 0,03 | 0,0001 | 900 000 | 140 |
| Argon | 18 | 0,022 | 0,007 | 0,0003 | 0,93 | 450 | 0 |
| Kalsium | 20 | 0,0067 | 0,007 | 5,1 | 0 | 410 000 | 1 000 |
| Nikkel | 28 | 0,0060 | 0,008 | 0,0072 | 0 | 6,6 | 0,001 |
| Aluminium | 13 | 0,0055 | 0,006 | 8 | 0 | 1 | 0,061 |
| Natrium | 11 | 0,0022 | 0,004 | 2,3 | 0 | 11 000 000 | 100 |
| Krom | 24 | 0,0014 | 0,002 | 0,0096 | 0 | 0,2 | 0,014 |
| Fosfor | 15 | 0,0007 | 0,0007 | 0,1 | 0 | 88 | 780 |
| Kalium | 19 | 0,0003 | 0,0004 | 1,7 | 0 | 390 000 | 140 |
| Titan | 22 | 0,0003 | 0,0004 | 0,86 | 0 | 1 | 0 |
| Klor | 17 | 0,0001 | 0,0008 | 0,019 | 0 | 19 000 000 | 95 |
| Fluor | 9 | 0,00004 | 0,00005 | 0,046 | 0 | 1 300 | 2,6 |
| Brom | 35 | 0,000007 | 0,0000002 | 0,0004 | 0 | 67 000 | 0,26 |
| Bor | 5 | 0,000001 | 0 | 0,0007 | 0 | 4 400 | 0,053 |
Det tyngste grunnstoffet som forekommer naturlig, er uran (atomnummer 92). Spor av neptunium (atomnummer 93) og plutonium (atomnummer 94) finnes i uranmalm, men disse er resultat av beta minus-henfall av uran, og defineres ikke som naturlige forekomster. Det letteste grunnstoffet som ikke forekommer naturlig er technetium (atomnummer 43). Alle de transurane grunnstoffene (med atomnummer høyere enn uran) fremstilles kunstig.
Isotoper
[rediger | rediger kilde]De fleste grunnstoffene har flere isotoper som forekommer naturlig, både stabile og ustabile. De ustabile isotopene omdannes ved nedbrytning av atomkjernen med ioniserende stråling som resultat (radioaktivitet). Tinn har 10 naturlig forekommende stabile isotoper, noe som er det høyeste antallet blant grunnstoffene. Technetium er det letteste grunnstoffet som ikke har noen stabile isotoper. Bly (atomnummer 82) er det tyngste grunnstoffet som har stabile isotoper. Før 2003 var vismut (atomnummer 83) ansett for å være det tyngste grunnstoffet med stabile isotoper, men det viser seg at det nedbrytes under utsendelse av alfastråling, og har en halveringstid på 1019 år (10 000 000 000 000 000 000 år). Den ekstremt lange halveringstiden og den meget svake strålingen gjør at vismut i alle praktiske henseender kan betraktes som stabilt og ikke radioaktivt.[10]
Administrasjon av periodesystemet
[rediger | rediger kilde]Periodesystemet og avgjørelser angående navn og kjemiske symbol administreres av den ikke-statlige internasjonale kjemi-organisasjonen International Union of Pure and Applied Chemistry (IUPAC). Organisasjonen står for oppdateringer og korrigeringer av periodesystemet, og har også avgjørende myndighet når oppdagelse og navngiving av nye grunnstoff skal godkjennes. Grunnstoffene 113, 115, 117 og 118 er rapportert fremstilt, og oppdagelsene ble bekreftet og godkjent av IUPAC i desember 2015.[11] Dersom oppdagelse av et nytt grunnstoff kan bekreftes, vil oppdagerne bli gitt anledning til å foreslå navn og kjemisk symbol.
Historie
[rediger | rediger kilde]
I antikkens Hellas foreslo Aristoteles at all materie i universet besto av grunn-elementene jord, luft, vann og ild i forskjellige proporsjoner. Inntil for omkring 350 år siden var dette den vanlige oppfatningen. I 1661 skrev den irske alkymisten Robert Boyle (1626–91) boken The Skeptical Chymist der han stilte seg kritisk til datidens alkymi og forestillingen om at all materie besto av bare fire grunnstoff. Boyle bidro sterkt til å gjøre alkymi til en analytisk vitenskap, og har blitt betegnet som en pioner innen moderne kjemi. Aristoteles' teori måtte forkastes på 1700-tallet da stadig nye grunnstoff ble oppdaget, og kjemikerne ikke greide å se noen sammenheng mellom dem og de forskjellige kjemiske forbindelsene.
De første skrittene
[rediger | rediger kilde]I 1828 utarbeidet den svenske kjemikeren Jöns Jakob Berzelius (1779–1848) en liste over grunnstoffene basert på relativ vekt. Han utviklet også et notasjonssystem der grunnstoffenes navn ble erstattet av bokstavforkortelser (kjemisk symbol) – et system som fortsatt er i bruk. På 1860-tallet var antallet oppdagede grunnstoff kommet opp i over 60, og det syntes som det ikke var noen grense for hvor mange kjemiske forbindelser som fantes. I 1864 utarbeidet den engelske kjemikeren John Alexander Reina Newlands (1837–98) en liste over grunnstoffene sortert etter relativ masse i stigende rekkefølge (ikke ulikt Berzelius' liste fra 1828). Han noterte seg at første og niende grunnstoff hadde kjemiske likhetstrekk, likeså andre og tiende. Basert på dette formulerte han i 1865 sin Law of Octaves – oktavenes lov (en oktav er et sprang på 8). Newlands' system viste seg ufullkomment og ufullstendig, noe han mente var forårsaket av uoppdagede grunnstoff. Newlands ble latterliggjort i sin samtid, men observasjonene hans hadde mye for seg (som Mendelejev skulle demonstrere noen år senere).
Det første utkastet
[rediger | rediger kilde]
I 1869 utarbeidet den russiske kjemiprofessoren Dmitrij Mendelejev en tabell over grunnstoffene som organiserte dem etter masse og kjemiske egenskaper. Denne tabellen viste ikke bare det kjemiske slektskapet mellom de forskjellige grunnstoffene, men kunne også forutsi både eksistensen av – og egenskapene til grunnstoff som til da ikke var oppdaget. Mendelejvs system inneholdt flere tomme plasser som senere skulle vise seg å romme grunnstoff som ennå ikke var oppdaget i Mendelejevs samtid. Unntaket var edelgassene som Mendelejev ikke hadde forutsett og satt av plass til. Disse ble tilføyd av William Ramsay senere uten at resten av tabellen behøvde modifisering. Med utviklingen av atomteorien økte forståelsen av atomenes indre oppbygning, og Mendelejevs system ble bekreftet. Massen som Mendelejev hadde sortert stoffene etter, viste seg å ha nøye sammenheng med antall protoner i kjernen, og de kjemiske egenskapene hadde sammenheng med antall elektroner i ytterste skall (gruppe).
Dagens periodesystem
[rediger | rediger kilde]Den (foreløpig) siste store endringen i periodesystemet kom i 1940 da den svenskættede amerikanske forskeren Glenn Theodore Seaborg (1912–99) innførte aktinoidene og plasserte dem under lantanoidene. Seaborg identifiserte flere av de transurane grunnstoffene, og mottok i 1951 nobelprisen i kjemi for sitt arbeid. I 1969 foreslo han også å utvide periodesystemet med periode 8 (og dermed 168 grunnstoff). Grunnstoff nummer 119 til 122 og 141 til 168 ville tilhøre de etablerte gruppene, mens nummer 123 til 140 ble plassert i den teoretiske g-blokken og kalt super-aktinoider sammen med nummer 140 til 153.[12] Utvidelsen er en logisk fortsettelse av periodesystemet, men er per mai 2022 ikke offisielt innført.
Se også
[rediger | rediger kilde]Referanser
[rediger | rediger kilde]- ^ «150 years of the periodic table: Test your knowledge». BBC News (på engelsk). 29. januar 2019. Besøkt 11. november 2020.
- ^ Gruppe-nummereringen «Tidligere» er den europeiske varianten (se avsnittet «Grupper»).
- ^ IUPAC – Gold Book Besøkt 10. januar 2016
- ^ Periodictable.com – Isotope data for Uranium238 Besøkt 10. januar 2016
- ^ American Physical Society – Search for superheavy elements using the 48Ca + 254Esg reaction Besøkt 10. januar 2016
- ^ IUPAC – New notations in the periodic table. Publisert 1988 (engelsk) (pdf) Besøkt 10. januar 2016
- ^ Universitetet i Oslo – Periodesystemet: Opprinnelse - Mest av hydrogen og helium Besøkt 10. januar 2016
- ^ Universitetet i Oslo - Periodesystemet Besøkt 10. januar 2016
- ^ Periodictable.com – Abundance in the Sun of the elements (engelsk) Besøkt 10. januar 2016
- ^ Universitetet i Oslo - Periodesystemet: Vismut[død lenke] Besøkt 10. januar 2016
- ^ IUPAC – Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118. (engelsk) Publisert 30. desember 2015 Arkivert 31. desember 2015 hos Wayback Machine. Besøkt 10. januar 2016
- ^ Glenn T. Seaborg: Prospects of Further Considerable Extension of the Periodic Table (engelsk) (pdf) Besøkt 10. januar 2016
Kilder
[rediger | rediger kilde]- Universitetet i Oslo – Periodesystemet Besøkt 10. januar 2016
- Forskning.no – Grunnstoffenes periodiske system Besøkt 10. januar 2016
- Ausetute.com – History of the Periodic Table of the Elements (engelsk) Besøkt 10. januar 2016
- Periodictable.com – The Elements. (omfattende engelskspråklig side om grunnstoffene) Besøkt 10. januar 2016
Eksterne lenker
[rediger | rediger kilde]- Dynamisk Periodesystem Besøkt 10. januar 2016
