Alkoholer

I organisk kjemi er alkoholer en fellesbetegnelse for stoffer som har en hydroksylgruppe, en -OH gruppe, som er bundet kovalent til et karbonatom. Den generelle formelen for alkoholer er ROH, hvor R betegner en alkylgruppe. Primære alkoholer har en terminal -OH gruppe, sekundære alkoholer har en -OH gruppe innebygget i karbonkjeden, mens tertiære alkoholer har en -OH gruppe ved en forgrening til karbonkjeden. Alle alkoholer får endingen -ol.
Alkoholer kjennetegnes ved at de generelt har et høyere smelte- og kokepunkt enn alkaner med tilsvarende molekylmasse. Grunnen til dette ligger i elektronfordelingen i hydroksylgruppen. Siden oksygen har en elektronegativitet på 3,5, mens hydrogen har en elektronegativtet på 2,1 vil oksygen trekke mer på elektronene i OH-bindingen enn hydrogen. Dette fører til at hydroksylgruppen blir polar. Dermed vil det dannes hydrogenbindinger mellom alkohol-molekylene og dette er altså grunnen til det høye koke- og smeltepunktet.
Alkoholer med korte karbonkjeder vil også være løselige i vann. Fordi både vannmolekyler og hydroksylgruppen er polare vil det også her dannes hydrogenbindinger. Hydroksylgruppen vil spille en mindre og mindre rolle når karbonkjeden blir lengre. Dermed mister molekylet sin polaritet og vil ikke lenger være løselig med vann. Alkoholer med mer enn fem karbonatomer i alkylkjeden er svært lite løselige i vann.
Primære alkoholer, sekundære alkoholer og aldehyder kan påvises ved å oksidere dem med MnO4-. Videre kan en skille alkoholer og aldehyder ved at alkoholer ikke reagerer med tollensreagens eller fehlings væske.
Alkoholer i industri[rediger | rediger kilde]
Alkoholer med opp til fire karbonatomer i kjeden blir fabrikkert i stor skala i industrien. De er viktige i seg selv, men blir også brukt til å fremstille andre viktige kjemikalier. Metanol var en av dem som ble produsert fra treverk ved destillering og blir også den dag i dag kalt for tresprit. I dag blir metanol fremstilt fra karbonmonoksid og hydrogen ved 400 °C, 150 atm sammen med ZnO og Cr2O3.
CO + 2H2 → CH3OH
USA produserer omtrent 5,3 milliarder liter hvert år. Mesteparten blir brukt til å produsere formaldehyd og andre kjemikalier, som for eksempel løsemidler og frysevæske. Etanol (den vi i dagligtale kaller for alkohol) er også viktig innen industrien og blir laget ved gjæring av sukker.
C12H22O11 + H2O → 4CH3CH2OH + 4CO2
Det finnes flere måter å produsere etanol på. Dette gjøres ved syrekatalysert hydrisering av etylen. Denne metoden, sammen med svovelsyre eller en annen syre som katalysator, blir benyttet til en årlig produksjon av ca. 525 millioner liter etanol i USA.
Alkohol i industrien er en konstant kokende mikstur av 95 % etanol og 5 % vann og kan ikke bli renere ved destillasjon. For å fjerne resterende vannmengde for å oppnå absolutt alkohol (100 %) tilsettes ulesket kalk (CaO), som reagerer med vannet og danner kalsiumhydroksid, men som ikke reagerer med etanol. Etanol blir også brukt som løsemiddel, sterilisering, og ved fremstilling av etere og etyl estere. Den kan også benyttes som drivstoff.
2-propanol (isopropyl alkohol) blir fremstilt fra syrekatalyse hybribisering av propen. 2-propanol er hovedproduktet i denaturert alkohol, blir også brukt i mange husholdningsprodukter og kosmetikk.
Viktige alkoholer i biologi[rediger | rediger kilde]
Hydroksylgruppen er innhold i mange biologisk viktige molekyler. 3-metyl-2-buten-1-ol, 3-metyl-3-buten-1-ol, geraniol og farnesol er eksempel på fire umettede og primære alkoholer som er metabolisk viktig.
Geraniol og farnesol er av en gruppe kalt terpen. Terpen forbindelser forekommer i mange planter og blomsterplanter. Farnesol er med å gi duft hos roser. Geraniol og farnesol blir brukt i parfymer.
Kombinasjon av to farnesol enheter gis squalene, et 30-karbon langt hydrokarbon og som er innhold i små menger i leveren hos høyere organismer. Squalene er den biologiske forløperen til steroider.
-
Farnesol
-
Geraniol
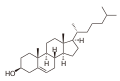
-
Kolesterol
-
Squalene
-
Urushiol[1] -
Coniferyl alkohol
Merk: Noen av navnene er på engelsk.
Enverdige alkoholer[rediger | rediger kilde]
- Metanol
- Etanol
- Propanol
- Butanol
- Pentanol
- Heksanol
- Heptanol
- Oktanol
- Nonanol
- Dekanol
- Undekanol
- Dodekanol
- Tridekanol
- Tetradekanol
- Pentadekanol
- Heksadekanol
- Heptadekanol
- Oktadekanol
- Nonadekanol
- Eicosanol
- Heneicosanol
- Docosanol
- Tricosanol
- Tetracosanol
- Pentacosanol
- Heksacosanol
- Heptacosanol
- Oktacosanol
- Nonacosanol
- Triacontanol
- Hentriacontanol
- Dotriacontanol
- Tritriacontanol
- Tetratriacontanol
- Pentatriacontanol
- Heksatriacontanol
Flerverdige alkoholer[rediger | rediger kilde]
Alkoholer med mer enn en OH-gruppe kalles for flerverdige alkoholer.
Toverdige[rediger | rediger kilde]
- Glykol (C2H4(OH)2) Brukes blant annet i frostvæske.
Treverdige[rediger | rediger kilde]
- Glyserol (C3H5(OH)3) Brukes blant annet i salver og i kosmetikk.
Spesielle alkoholer[rediger | rediger kilde]
Se også[rediger | rediger kilde]
Referanser[rediger | rediger kilde]
- ^ -R kan være for eksempel (CH2)7CH=CH(CH2)5CH3
Litteratur[rediger | rediger kilde]
- Harold Hart, Lesilie E. Craine, David J. Hart, Christopher M. Hadad (2007). Organic Chemistry, A short course. Houghton Mifflin Company. ISBN 0-618-59073-0.


![Urushiol[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7e/Urushiol.svg/115px-Urushiol.svg.png)