Arener
Arener (eller aromatiske hydrokarboner) er en gruppe innen den organiske kjemien. Arenene inneholder minst en aromatisk ring (mest kjent er benzenringen, som har seks karbonatomer bundet sammen i en ring). Benzen er den enkleste aromatiske forbindelsen, den består av en kun en ring, derav navnet benzenring.
Bindingsforhold
[rediger | rediger kilde]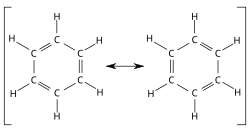
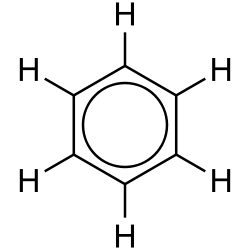
Benzens ringstruktur ble først avklart av den tyske kjemikeren Kekulé von Stradonitz. Han beskrev benzenmolekylet som en sekskantet «ring», hvor hvert av hjørnene i sekskanten utgjøres av et karbonatom. Mellom karbonatomene er det ifølge Kekulé vekselvis enkelt- og dobbeltbindinger. Ringen er plan, dvs. at den ikke er tredimensjonal.
Til støtte for denne teorien kunne fremføres at benzen og øvrige arener i likhet med andre umettede hydrokarboner ved forbrenning utvikler sot som tegn på at de ikke forbrenner fullstendig med O2.
Imidlertid viser benzen ikke et annet typisk trekk ved umettede forbindelser: evnen til å reagere med brom ved en addisjonsreaksjon, slik at brom avfarges. Denne såkalte bromtesten er ellers positiv for alle forbindelser med dobbeltbinding, f. eks. for sykloheksen, som i likhet med benzen består av seks karbonatomer i en ring, men hvor det er én dobbeltbinding. Denne iakttakelsen ledet til en erkjennelse av at konjugerte dobbeltbindinger, det vil si dobbeltbindinger som alternerer med enkeltbindinger, som i benzen, oppfører seg annerledes enn isolerte dobbeltbindinger. Dette ble lenge forsøkt forklart ved at disse forelå som en likevekt av to isomere former som stadig omdannes i hverandre, men som ikke kunne isoleres fra hverandre (se figuren ovenfor). Dette mente man førte til at dobbeltbindingen hele tiden skiftet plass, og man beskrev det som delokaliserte dobbeltbindinger.

Røntgenkrystallografiske studier viste at alle bindingsavstandene mellom karbonatomene i et benzenmolekyl er like, og ligger nær midt mellom avstandene i en C-C-enkeltbinding og en dobbeltbinding. Dette støttet på den ene siden inntrykket av at dobbeltbindingene ikke er lokalisert, men førte også til at det ble stilt spørsmålstegn ved modellen med alternerende enkelt- og dobbeltbindinger. Moderne orbitalteori, som bygger på kvantemekanikk, forklarer benzenmolekylets struktur som et resultat av enkeltbinding mellom hvert nabopar av karbonatomer med en helt spesiell binding i tillegg. Denne «superbindingen» omfatter alle seks karbonatomer i benzenringen og oppstår ved at hvert av karbonatomene inngår i en elektronsituasjon som om de skulle danne en dobbeltbinding, men i stedet inngår elektronene i en ringomspennende binding.
Benzenderivater
[rediger | rediger kilde]
Alle substituerte benzenderivater har den typiske benzenringen og betegnes som aromater. Spesielt for aromatiske hydrokarboner er at de som navnet tilsier bare inneholder grunnstoffene hydrogen og karbon. Eksempler på kjente aromater som ikke er hydrokarboner er benzosyre, benzaldehyd, kanelaldehyd, vanillin og trinitrotoluen.
Andre aromatiske stoffer inneholder to eller flere benzenringer, som eksempel bifenyl (utgangspunkt for miljøgiftene PCB), naftalen og miljøgiftene PAH.
Beslektede stoffer
[rediger | rediger kilde]Ved å erstatte ett av karbonatomene i benzen med et nitrogenatom oppstår pyridin, som har mange egenskaper til felles med benzen. En rekke biokjemisk viktige stoffer inneholder ringsystemer som likner benzenringen, men har flere nitrogenatomer istedenfor karbon i ringen. De kan inneholde femleddete eller seksleddete ringer. Eksempler er nitrogenbasene i DNA og RNA. Ringskjelettet i disse er enten pyrimidin eller purin.
Se også
[rediger | rediger kilde]Litteratur
[rediger | rediger kilde]- Klein, David R. (2012). Organic Chemistry. Hoboken, N.J. John Wiley. ISBN 9780471756149.
- Bruice, Paula Yurkanis (2010). Essential Organic Chemistry (2 utg.). Boston. Prentice Hall. ISBN 9780321644169.
- McMurry, John; McMurry, Susan (2012). Organic Chemistry (8 utg.). Belmont, CA. Brooks/Cole. ISBN 0840054556.
- Chang, Raymond (2008). General chemistry : the essential concepts (5 utg.). Boston. McGraw-Hill. ISBN 9780071102261.
- Chang, Raymond; Goldsby, Kenneth A. (2014). General chemistry : the essential concepts (7 utg.). New York. McGraw-Hill. ISBN 9781259060427.
