Karsinogenese
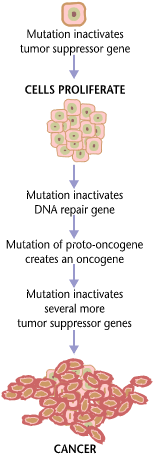
Karsinogenese er prosessen hvorved normale celler omdannes til kreftceller, det vil si hvordan kreftsvulster dannes og utvikles. Prosessen er karakterisert ved faktiske forandringer på det genetiske og epigenetiske nivået i celler som fører til ukontrollert cellevekst. Ordet karsinogenese betyr bokstavelig talt «dannelse av kreft».
Celledeling er en fysiologisk prosess som foregår i nesten alt vev og under mange forutsetninger. Under vanlige tilstander foregår celledeling i en nøye kontrollert balanse mellom vekst og programmert celledød, vanligvis apoptose. Mutasjoner og epimutasjoner i DNA forrykker denne balansen ved å forstyrre programmeringen i som regulerer cellevekst og celledød. Disse mutasjonene er den direkte årsaken til karsinogenese, og resultatet er ukontrollert cellevekst av disse cellene og deres overlevelse i kroppen. Denne ukontrollerte og ofte hurtige veksten av disse muterte cellene kan føre til godartede svulster, hvor noen av disse kan utvikle seg til ondartede svulster (kreft). Godartede svulster sprer seg ikke til andre deler av kroppen og invaderer ikke andre typer vev. Disse utgjør sjelden en trussel mot liv med mindre de presser mot vitale strukturer eller er fysiologisk aktive ved for eksempel å produsere et hormon eller lignende. Ondartede svulster kan invadere andre organer og vev, samt spre seg til andre deler av kroppen (metastase) og dermed bli livstruende.
Mer enn en mutasjon er nødvendig for å forårsake karsinogenese. En rekke spesifikke gener må rammes av mutasjoner for at en normal celle skal transformeres til en kreftcelle [1]. Eksempelvis er det gjennomsnittlig 15 større mutasjoner, samt 60 mindre mutasjoner, som forårsaker tarmkreft[2]. De muterte genene spiller gjerne viktige roller i celledeling, DNA-reparasjon og apoptose (celledød).
Kreft er fundamentalt en svikt i regulering av cellevekst. For at normale celler skal transformeres til kreftceller så må gener som regulerer vekst og differensering endres[3]. Genetiske og epigenetiske forandringer kan foregå på flere vis, som ved anskaffelse eller tap av hele kromosomer, eller til mutasjoner som påvirker ett enkelt nukleotid i DNA, eller ved deaktivering (silencing) eller aktivering av microRNA som kan regulere uttrykket av alt fra 100-500 gener[4][5]. Det er 2 brede kategorier for gener som blir påvirket av slike forandringer. Onkogener kan være normale gener som blir uttrykt i et unormalt høyt nivå, eller det kan være direkte endrede gener som har roller direkte knyttet opp til regulering av cellevekst. I begge tilfeller vil disse forandringene promotere fremvekst av kreftceller. Kreft-inhiberende gener er gener som har som oppgave å hindre celledeling, cellens evne til å overleve, eller andre egenskaper som fører fremvekst av kreftceller. Kreft-inhiberende gener blir ofte deaktivert av kreft-promoterende genetiske forandringer. Typisk så kreves det en stor menge av de ovennevnte forandringene for å forårsake en normal celle sin transformasjon til en kreftcelle[2][6].
Større mutasjoner defineres gjerne som sletting eller anskaffelse av større deler i et kromosom. Genomisk amplifisering skjer gjerne når en celle erverver seg mange kopier (ofte 20 eller mer) av en liten seksjon av et kromosom, som da vanligvis inneholder ett eller flere onkogener eller relatert genetisk materiell. Translokering foregår når to separate kromosomregioner blir abnormt sammensveiset, ofte ved en karakteristisk region på kromosomet. Et velkjent eksempel på dette er Philadelphia-kromsomet som er forårsaket av translokering av kromosom 9 og 22, noe som videre fører til kronisk myelogen leukemi.
Mindre mutasjoner inkluderer punkt mutasjoner, delesjon og innsetting. Disse mutasjonene kan for eksempel forekomme i en promotor til et gen og dermed påvirke genets uttrykk, eller så kan disse mutasjonene forekomme i den kodende delen av genet og forandre funksjon eller stabilitet til proteinproduktet. Forstyrring av et enkelt gen kan også forårsakes av integrering av viralt genomisk materiell.
Epimutasjoner forekommer vanligvis ved metyleringer eller demetyleringer av de CpG rike regionene av promoterene til gener, som resulterer i endret aktivitet av et genuttrykk[7][8][9]. Epimutasjoner kan i tillegg til metyleringer forekomme ved acetylering, fosforylering, eller andre endringer ved histoner som forårsaker en histonkode som hemmer eller aktiverer genuttrykk. Slike epimutasjoner kan være viktige epigenetiske faktorer som fører til kreft[10][11]. I tillegg til dette så kan karsinogene epimutasjoner forekomme gjennom endringer av kromosomarkitektur forårsaket av proteiner slik som HMGA2[12]. Utover dette så kan et økt eller senket uttrykk av microRNA være et opphav til epimutasjoner. Et eksempel på dette er at et forhøyet uttrykk av miR-137 kan forårsake nedreguleringen av 491 genuttrykk, og at uttrykket av miR-137 er epigenetisk hemmet i 32% av tilfeller tarmkreft[5].
Referanser
[rediger | rediger kilde]- ^ Eric R. Fearon, Bert Vogelstein (1. juni 1990). «A genetic model for colorectal tumorigenesis». Cell.
- ^ a b Laura D. Wood1,*, D. Williams Parsons1,*, Siân Jones1,*, Jimmy Lin1,*, Tobias Sjöblom1,*,†, Rebecca J. Leary1, Dong Shen1, Simina M. Boca1,2, Thomas Barber1,‡, Janine Ptak1, Natalie Silliman1, Steve Szabo1, Zoltan Dezso3, Vadim Ustyanksky3, Tatiana Nikolskaya3,4, Yuri Nikolsky3, Rachel Karchin5, Paul A. Wilson5, Joshua S. Kaminker6, Zemin Zhang6, Randal Croshaw7, Joseph Willis8, Dawn Dawson8, Michail Shipitsin9, James K. V. Willson10, Saraswati Sukumar11, Kornelia Polyak9, Ben Ho Park11, Charit L. Pethiyagoda12, P. V. Krishna Pant12, Dennis G. Ballinger12, Andrew B. Sparks12,§, James Hartigan13, Douglas R. Smith13, Erick Suh13, Nickolas Papadopoulos1, Phillip Buckhaults7, Sanford D. Markowitz14, Giovanni Parmigiani1,∥, Kenneth W. Kinzler1,∥, Victor E. Velculescu1,∥, Bert Vogelstein1,∥ (11. oktober 2007). «The Genomic Landscapes of Human Breast and Colorectal Cancers». Science.
- ^ Carlo M. Croce, M.D. (31. januar 2008). «Oncogenes and Cancer». The New England Journal of Medicine.
- ^ Lee P. Lim, Nelson C. Lau, Philip Garrett-Engele, Andrew Grimson, Janell M. Schelter, John Castle, David P. Bartel, Peter S. Linsley & Jason M. Johnson (30. januar 2005). «Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs». Nature. Besøkt 13. mai 2015.
- ^ a b Francesc Balaguer, Alexander Link, Juan Jose Lozano, Miriam Cuatrecasas, Takeshi Nagasaka, C. Richard Boland, and Ajay Goel (15. august 2010). «Epigenetic Silencing of miR-137 Is an Early Event in Colorectal Carcinogenesis». Cancer Research. Besøkt 13. mai 2015.
- ^ Alfred G. Knudson (november 2001). «Two genetic hits (more or less) to cancer». Nature.
- ^ Filipe Ivan Daniel1,2,†,*, Karen Cherubini1, Liliane Soares Yurgel1, Maria Antonia Zancanaro de Figueiredo1 andFernanda Gonçalves Salum1 (13. oktober 2010). «The role of epigenetic transcription repression and DNA methyltransferases in cancer». Cancer.
- ^ R Kanwal and S Gupta (8. desember 2011). «Epigenetic modifications in cancer». Clinical Genetics.
- ^ Kavita M. Pattani , Ethan Soudry , Chad A. Glazer, Michael F. Ochs, Hao Wang, Juliana Schussel, Wenyue Sun, Patrick Hennessey, Wojciech Mydlarz, Myriam Loyo, Semra Demokan, Ian M. Smith, Joseph A. Califano (24. september 2012). «MAGEB2 is Activated by Promoter Demethylation in Head and Neck Squamous Cell Carcinoma». PLOS one.
- ^ Deepa Sampath, Chaomei Liu, Karthik Vasan, Melanie Sulda, Vinay K. Puduvalli, William G. Wierda, and Michael J. Keating (2011). «Histone deacetylases mediate the silencing of miR-15a, miR-16, and miR-29b in chronic lymphocytic leukemia». Blood Journal.
- ^ Michael J. Hitchler, Larry W. Oberley, Frederick E. Domann (2011). «Epigenetic silencing of SOD2 by histone modifications in human breast cancer cells». Free Radical Biology and Medicine.
- ^ Gustavo Baldassarre, Sabrina Battista, Barbara Belletti, Sanjay Thakur, Francesca Pentimalli, Francesco Trapasso, Monica Fedele, Giovanna Pierantoni, Carlo M. Croce and Alfredo Fusco (2003). «Negative Regulation of BRCA1 Gene Expression by HMGA1 Proteins Accounts for the Reduced BRCA1 Protein Levels in Sporadic Breast Carcinoma». Molecular and Cellular Biology.
