SN2-reaksjon
SN2-reaksjon (også kalt substitusjon nukleofil bimolekylær reaksjon[1]) er en type nukleofil substitusjonsreaksjon, hvor et enslig elektronpar fra den nukleofile «angriper» et elektron-fattig senter og binder seg til det og dytter ut den andre gruppen, også kalt for den forlatende gruppe.[2] Tallet to i SN2 betyr at mekanismen er bimolekylær, det er to molekyler –nukleofile og substrat– som er involvert i reaksjonen.
Mekanisme
[rediger | rediger kilde]
SN2-mekanismen er en entrinns prosess (i forskjell fra SN1 som er totrinns). I reaksjonen angriper det nukleofile reagenset på baksiden av karbon-atomet.[3] Det angriper på baksiden fordi det i sp3-hybridisering er en liten flikk (se bilde) som stikker ut.[4] I en del av reaksjonen (overgangsfasen, transition state) er den nukleofile gruppen og den forlatende gruppen delvis bundet til karbon når substitusjonen skjer. Når den forlatende gruppen drar avsted tar den med seg sitt elektronpar, og det nukleofile reagenset deler sitt eget elektronpar med karbonet.
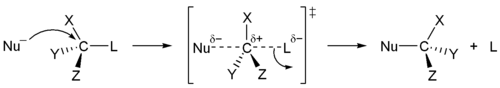
SN2-reaksjoner er avhengige av konsentrasjonen av både det nukleofile reagenset og substratet. Om vi for eksempel dobler mengden av NaOH vil reaksjonen gå dobbelt så raskt. Det samme vil skje om vi dobler konsentrasjonen av substratet. Når en SN2-reaksjon skjer vil vi få en inversjon av molekylet, det betyr at om vi lar (R)-2-brombutan reagere med NaOH vil vi få (S)-2-butanol. Les mer om stereoisomeri.
SN2-reaksjoner går raskest når alkyl-gruppen er 1° (primær) og går sakte når gruppen er 3° (tertiær). Dette er fordi baksiden av karbon-atomet er mer blokkert av sidegrupper når gruppen er 3°.
Se også
[rediger | rediger kilde]Referanser
[rediger | rediger kilde]- ^ «Chapter 4: SN2 mechanism». Arkivert fra originalen 27. april 2007. Besøkt 7. mai 2007.
- ^ Chemhelper, The SN2 reaction mechanism
- ^ Chemhelper, The SN2 reaction mechanism
- ^ MHHE, Chapter 2: sp3 hybridization
Litteratur
[rediger | rediger kilde]- Harold Hart, Lesilie E. Craine, David J. Hart, Christopher M. Hadad (2007). Organic Chemistry, A short course. Houghton Mifflin Company. ISBN 0-618-59073-0.
Eksterne lenker
[rediger | rediger kilde]- (en) SN2 reactions – kategori av bilder, video eller lyd på Commons
- Michigan State University, SN2 Reaction Mechanism
