Bromtymolblått
Utseende
Kildeløs: Denne artikkelen mangler kildehenvisninger, og opplysningene i den kan dermed være vanskelige å verifisere. Kildeløst materiale kan bli fjernet. Helt uten kilder. (10. okt. 2015) |
| Bromtymolblått | |||||
|---|---|---|---|---|---|
| |||||
| Systematisk navn | |||||
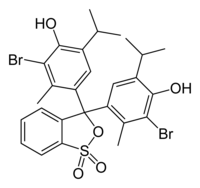
| 4,4′-(1,1-Dioxido-3H-2,1-benzoxathiole-3,3-diyl)bis(2-bromo-6-isopropyl-3-methylphenol) | |||||
| Andre navn | |||||
| BTB | |||||
| Identifikatorer | |||||
| CAS-nummer | |||||
| SMILES | Brc1c(O)c(cc(c1C)C3(OS(=O)(=O)c2ccccc23)c4cc(c(O)c(Br)c4C)C(C)C)C(C)C | ||||
| Kjemiske egenskaper | |||||
| Formel | C27H28Br2O5S | ||||
| Molar masse | 624,38 g/mol | ||||
| Tetthet | 1250 kg/m3 | ||||
| Smeltepunkt | 202 °C | ||||
| Løselighet | Litt løselig i vann | ||||
| pKa | 7,0 | ||||
Bromtymolblått (BTB) er en indikator. Den er mest brukt ved målinger der en jobber nærme nøytrale pHer.
BTB får en gul farge i sure løsninger og en blå farge i basiske(alkaliske) løsninger. I nøytrale løsninger vil BTB være grønn. BTB egner seg til å måle svake syrer og baser, da den blir gul ved pH under 6,0 og blå ved pH over 7,6. Ved pH under 0 vil BTB gi ein rosa farge.
En vanlig måte å demonstrere denne indikatoren på er å blåse med et rør ned i en nøytral løsning tilsatt BTB. Karbondioksiden man puster ut vil reagere med vannet og danne karbonsyre, og dermed vil indikatoren bli gul.


Denne artikkelen er en spire. Du kan hjelpe Wikipedia ved å utvide den.
Autoritetsdata