IPNV (Infeksiøs pankreas nekrose virus): Forskjell mellom sideversjoner
Ingen redigeringsforklaring |
|||
| Linje 81: | Linje 81: | ||
• IPNV kan også smitte gjennom fòr som ikke har blitt korrekt bearbeidet og kontrollert hos produsent. Nøye kontroll kan forebygge og utelukke smitte fra fòr. |
• IPNV kan også smitte gjennom fòr som ikke har blitt korrekt bearbeidet og kontrollert hos produsent. Nøye kontroll kan forebygge og utelukke smitte fra fòr. |
||
== Referanser == |
|||
1. «Fiskehelse og fiskesykdommer». Poppe, Trygve. Universitetsforlaget, 2002. ISBN 8200127184 |
|||
<br />2. «Immunologi og immunologiske teknikker». Lea, T. Fagbokforlaget, 2003. ISBN 82-450-0219-4 |
|||
=== Internett-linker === |
|||
http://www.fiskerifond.no/files/projects/attach/ipnsalmonids.pdf Fiskeri- og havbruksnæringens landsforening. Evensen Ø., Rimstad E., Stagg R., Brun E., Midtlyng P., Skjelstad B., et al. (Oktober 2003). ''IPN in salmonids, a review'' |
|||
<br />http://www.fiskerifond.no/files/projects/attach/faktaomipn1.pdf Fiskeri- og havbruksnæringens landsforening. Aunsmo A., Garseth Å. H., Maroni K., Evensen Ø. (Januar 2005). ''Fakta om IPN'' |
|||
<br />http://www.kyst.no/index.php?page_id=59&offset1=25&article_id=75676 Norsk Fiskeoppdrett AS – kyst.no. (22 September 2006). ''Kan snart vaksinere yngel mot IPN'' |
|||
http://www.imr.no/__data/page/8431/3.3.1_Helsesituasjonen_hos_laksefisk.pdf Institute Of Marine Research. Skjelstad H. R., Bornø G., Flesjå K., Hansen H., Nilsen H., Wasmuth M. A. et al. (2008) ''Helsesituasjonen hos oppdrettsfisk 2007''. |
|||
[[Kategori:Virus]] |
[[Kategori:Virus]] |
||
Sideversjonen fra 7. nov. 2008 kl. 20:20
Infeksiøs pankreas nekrose virus, IPNV, er det første fiskepatogene virus som ble isolert fra cellekultur og beskrevet i 1958. IPNV rammer først og fremst salmonider i Norge (atlantisk laks, sjøørret og sjørøye). Viruset forårsaker infeksiøs pankreas nekrose, IPN. Sykdommen er kjent helt tilbake til 1941, da som enteritt (tarmbetennelse) på bekkerøye i Canada. IPN er påvist over store deler av verden, og i Norge har sykdommen vært et stort problem helt siden 1985. I 2001 anslo man at de økonomiske tapene, som en følge av IPN, lå mellom 350 - 400 millioner NOK per år bare i Norge. I 2007 ble IPN påvist på 165 forskjellige lokaliteter i Norge.
Beskrivelse
IPNV er et akvatisk birnavirus og tilhører familien Birnaviridae. Inndelingen av akvatiske birnavirus har utviklet seg fra å omfatte 3 serotyper (amerikansk "VR 299" og to europeiske "Sp" og "Ab"), til to adskilte serogrupper A og B. Serogruppe A inneholder ni serotyper av viruset som blir kalt IPNV. I Norge er serotype Sp den vanligste varianten av IPNV. Serogruppe B omfatter isolater fra skalldyr og blir ikke omtalt som IPNV, men i stedet som akvatisk birnavirus.
En infeksjon med IPNV fører nødvendigvis ikke til sykdom eller død hos laks. Viruset kan ligge latent i fisken under hele livssyklusen. Det er kun juvenil fisk som lakseyngel, men også og postsmolt 7-12 uker etter at den er blitt satt ut i sjøvann, som angripes av IPNV. Dette kommer av at fiskens immunsystem ikke fullt ut er utviklet på dette stadiet, og er mer utsatt for stress som ved bakterieangrep, PD, gjellebetennelse og endringer i miljø.
Man antar at IPNV spres både horisontalt og vertikalt. Det kommer seg trolig inn i fiskens blodbaner via fordøyelseskanalen og gjeller ved horisontal smitte. Ved vertikal smitte befinner viruset seg enten inne i sædcellen eller rognkornet, eller på overflaten av disse. Det mistenkes at IPNV kan komme seg inn i egg hos atlantisk laks via spermier. Man har påvist vertikal smitte fra foreldre til avkom hos bekkerøye og regnbueørret. Dette er imidlertid mer usikkert med laks. Det finnes i dag ingen effektive vaksiner mot IPNV, selv om de til en viss grad har greid å redusere dødeligheten. Nye vaksiner som stadig utvikles viser en positiv trend mot å få en effektiv vaksine mot sykdommen.
Det finnes lavvirulente og høyvirulente stammer av IPNV med ulik evne til å fremkalle sykdom. Disse lavvirulente og høyvirulente stammene forekommer i blanding med varierende dominans. Man kan derfor ha tilfeller hvor opptil 90 % av fisken kan dø, til ingen dødelighet i det hele tatt.
IPNV et et svært lite vertsspesifikt virus, noe som betyr at hele 32 familier av fisk er blitt infisert (blant annet piggvar, kveite, torsk og ål), i tillegg til blekksprut, snegler (blant annet kamskjell), skjell og krepsdyr, både i ferskvann og i saltvann. Disse artene utvikler ikke sykdom, men er bærere av viruset.
Oppbygning
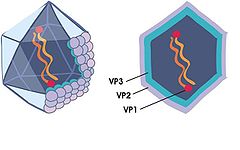
Viruset er ca 60 nm i diameter og ikosaedrisk symmetrisk, med et nakent kapsid uten en ytre membran, som gjør at den svært robust mot ytre påkjenning. Det kan tåle uttørking og overleve i både fersk og sjøvann for lengre perioder. Dessuten tåler det høy temperatur og resistent mot lav pH. Den er også svært resistent mot UV-lys. Dens genom består av en dobbelt trådet RNA med to genomiske segmenter, A og B. Disse to segmentene koder for fem virusproteiner VP1-VP5. Genomsegmentet A koder for ett polyprotein som igjen koder for fire virusproteiner. Et av disse virusproteinene er enzymet VP4 (NS-protease) som klipper opp polyproteinet til de mindre bitene preVP2, VP3 og VP5. Kapsidproteinene preVP2 og VP3 er strukturproteiner mens VP4 og VP5 er ikke-strukturproteiner. I løpet av en infeksjonssyklus blir preVP2 og VP3 hovedsakelig produsert ved spalting av polyproteinet ved hjelp av NS-proteasen, mens den videre bearbeidingen av preVP2 til VP2 antagelig blir utført av proteaser i vertscellen. Genomsegment B koder for den RNA-avhengige RNA-polymerasen VP1, som er ansvarlig for replikasjon av virusgenomet under en infeksjonssyklus. VP1 finnes i to former inne i kapsidet; kovalent bundet til hvert genomsegment VPg, og som i fri form. Man tror at VPg virker som en egen primer under in vitro RNA syntese.
Virulens og patogenitet
Viruset spres i blodet og etablerer seg i bukspyttkjertel, lever, milt og nyrer og forårsaker nekroser i den eksokrine delen av bukspyttkjertelen ved en infeksjon hos laks. Viruset ødelegger cellene som produserer fordøyelsesenzymer i bukspyttkjertelen, og til tross for at fisken har god appetitt, vil de avmagres fordi evnen til å fordøye fett og protein reduseres. Det er to virusproteiner som man antar spiller en viktig rolle for IPNV virulens og patogenitet, VP2 og VP5. VP2 er eksponert på utsiden av kapsidet og man antar at det spiller en viktig rolle ved bindingen til vertsceller ved en infeksjon. I all hovedsak er det også VP2 som bærer epitopene. Epitoper er områder på hvor antistoffer kan binde sine respektive bindingseter. Epitopene hos VP2 induserer produksjon av nøytraliserende antistoffer hos vertsorganismen, og dermed med på å bestemme virusets serotype ved immunologiske tester. Forskjeller i aminosyresekvensene i proteinet avgjør om viruset blir høy-virulent eller lav-virulent. Det er TAT-varianten av VP2 som er kjent for å gi høy dødelighet. Dette proteinet har treonin (T), alanin (A) og treonin (T) som aminosyrer på plass nummer 217, 221 og 247. Mens for lavvirulente varianter er det PAT-varianten som gir lav eller ingen dødelighet. VP5 viser seg å motarbeide forsvarsmekanismer som utløser apoptose (programmert celledød) før nekrose i verten. Dette gjør den ved å innvirke på det cellulære genet som koder for ”selvmord” i den tidlige replikasjonsfasen, og kan dermed forsterke reproduksjonen av viruset.
Synlige tegn hos fisken ved utbrudd av IPN er hos yngel tap av appetitt, drifting rundt i karet, svekket svømmeevne og sviming. Hos parr er tegnene de samme, men de får en mørkere pigmentering i skinnet, og en akutt nedsatt appetitt. Gule tråder av oppløst mukos-assosiert vev hengende ut fra gatt er også et kjennetegn. Blødninger på buken og ved finnebasis, samt bleke gjeller og utspilte øyne (exophthalmos) er typiske tegn. Omfattende punktblødninger forekommer også, samt tom tarm og væskeansamling i bukhulen (ascites). Avmagrede individer kan indikere IPNV. Ved mikroskopi kan man se forandringer i pankreas hvor nekrotiske områder fremstår som lyse og strukturløse. Hos yngel og settefisk er ofte leveren blek som følge av leverskade.
Påvisningsmetoder for IPNV
I dag er det utviklet flere ulike metoder for påvisning av IPNV. De fleste foregår på laboratorier, men det er også utviklet test-kit som en enkelt kan bruke på lokaliteten.
Histopatologi og Immunhistokjemi
Mistanken om IPNV kan underbygges ved bruk av histopatologi, men kan med sikkerhet blir diagnostisert og bekreftet ved immunhistokjemi.
Histopatologi
Histopatologi er en metode for å finne sykdommer ved visuelle undersøkelser av laksens vev. Dette gjøres hovedsakelig ved å studere vevsprøver i mikroskop for å finne skader, deformiteter og andre sykdomstegn hos laks. Dette kan gi indikasjoner på hvilken sykdom det kan være, eller om skade i vevsstrukturen skyldes ytre påvirkning.
Immunhistokjemi
Immunhistokjemi er en måte å identifisere og lokalisere antigene strukturer i vev fra laks. Metoden påviser virus i formalinfiksert vev ved at det anvendes en spesiell innfargingsmetode som utnytter den spesifikke bindingen mellom antigen som ligger i snittet, og antistoff som påføres. Prinsippet likner ELISA hvor antigen er festet til vevsnittet og påvises med et merket antistoff. Immunmerking av histologiske seksjoner hvor man bruker polyklonale antistoffer er en vanlig bekreftende test for IPN.
Identifikasjon og påvisning av virus ved bruk av serologi
Serologi er metoder hvor man bruker en spesifikk antigen-antistoffreaksjon for å bestemme og identifisere et spesielt antigen til en fremmed organisme. De mest brukte testene for virusidentifisering ved hjelp av serologi er ELISA testen, nøytraliseringstesten, immunflouresens testen og co-agglutinasjonstest.
Elisa testen
Elisa testen bruker et polyklonalt antistoff for å fange viruset man ønsker. Det fangede viruset blir gjenkjent av et sekundært antistoff fra en annen art, eller et monoklonalt antistoff. Dette blir i en rekkefølge gjenkjent av et tredje antistoff som er forent med et enzym som produserer en fargereaksjon. Man får dermed utslag ved fargeforandring om viruset er tilstede i prøven man tester.
Nøytraliseringstesten
Nøytraliseringstesten går ut på å identifisere viruset ved å bruke spesifikke antistoffer. Det er to måter å utføre testen på. Den ene går ut på å variere konsentrasjonen av virus mot en konstant mengde av antiserum. Denne testen gir svar innen fire dager. Den andre metoden er å variere på konsentrasjonen av antiserum mot en konstant mengde virus. Denne reaksjonen er tregere, og det krever at konsentrasjonen av titreringsvæske av virus er forhåndsbestemt.
Immunfluoresens testen
Immunflouresens testen er utført ved å fiksere virus infiserte celler, og inkubere de sammen med et polyklonalt eller monoklonalt antistoff til IPN viruset. Et sekundært antistoff sammen med en farge som floureserer ved en spesifikk bølgelengde av synlig lys, er da brukt for å visualisere virus antigenet.
Co-agglutinasjons testen
Co-agglutinasjons test er en hurtigtest som blir brukt for å påvise IPNV i salmonider der en har mistanke om smitte. Testen er en co-agglutinasjons test der antigen fra infisert vev som er tatt fra laks reagerer med antistoff-besatte Staphylococcus aureus. Testene kan ikke brukes for å påvise eventuelle bærere siden de ofte har et mye lavere virus nivå en testen krever for og reagere. Påvisning av agglutinasjon observeres som forklumpning av partikler i serumet som det testes i.
Virus isolering i cellekulturer
Har en påvist IPNV for eksempel med en Co-agglutinasjonstest kan en gå videre og dyrke frem viruset på diverse cellekulturer. Dyrkingen foregår på kjente cellelinjer fra fisk. De mest brukte cellekulturene er BF-2, CHSE-214 og RTG-2. Om virus vokser frem på cellekulturen vil en i løpet av 48 timer kunne observere sprengte celler (CPE) i lysmikroskop. Om cellekulturen inneholder små mengder virus tyder dette på at fisken er bærer av viruset. Noen eksakte grenseverdier for når fisken er bærer eller har utbrudd, finnes ikke. Om det ikke påvises noe virus ved dyrkingen i cellekulturen er fisken enten fri for virus eller en frisk smittebærer.
Virus identifisering ved bruk av PCR
Identifisering av IPNV ved hjelp av PCR teknikker blir i dag mye brukt. Denne metoden er mer følsom enn virus isolering og gir dermed økt sannsynlighet for påvisning. PCR går ut på å danne mange kopier av en spesifikk nukleotidsekvens in vitro. En bruker kjente målsekvenser (DNA-templatsekvens) som er karakteristiske (spesifikke) for organismen en ønsker å påvise og finnes de i prøven vil de bli mangedoblet. PCR foregår ved økning og senkning av temperauren til en prøvemiks i flere sykluser. Når temperaturen heves til rundt 95 °C vil DNA helixen bli denaturert, dvs. at det går fra dsDNA til ssDNA fordi hydrogenbindingene mellom nukleotidene i spiralen brytes og åpner seg. Etter dette senkes temperaturen til rundt 50 °C (40-70°C) slik at primerne og probene skal binde seg til sine respektive områder. Størrelsen på en primer er normalt 20-30 baser, og hvor høy temperaturen i dette trinnet kan være er avhengig av størrelsen; for at en primer skal kunne feste seg, må temperaturen være under smeltepunktet til primeren(vanligvis ca. 5ºC under). Smeltepunktet varierer med størrelsen slik at store primere har høyt smeltepunkt. Primere er korte fragmenter av DNA som ved PCR blir brukes til å indusere syntese av DNA. Til hver PCR trengs det to primere, en som er komplementær til starten av genet (forward) og en til slutten (reverse). Primerne bestemmer start og stopp for kopieringen og lager enkeltrådede DNA-sekvenser. En probe er et modifisert DNA oligonukleotid og den vil øke spesifisiteten til forsøket da den binder seg kun til 100 % komplementært DNA. Etter at primerne og probene er bundet seg til DNA-tråden økes temperaturen til 72 °C slik at en får aktivert Taq-polymereraser (enzym) som fyller inn nukleotider. Taq binder seg til primerne og setter sammen DNA-nukleotider slik at vi får dannet en DNA-heliks. Taq-polymerase (fra bakterien Thermus aqaticus) er mer termostabil da bruk av en standard DNA-polymerase ville ført til denaturering sammen med DNAet under første oppvarming til 95 °C. Syklusen gjentas flere ganger og en får dannet millioner av kopier. Før RNA kan brukes til PCR undersøkelser må RNAet omskrives til cDNA. Dette skjer ved hjelp av enzymet revers transkriptase som bruker isolert mRNA for å lage en enkel DNA-tråd.
Real-Time PCR
I molekylærbiologi er Real-time polymerase chain reaction, også kalt kvalitativ real-time PCR (qPCR), en laboratorieteknikk basert på polymerase kjede reaksjon som blir brukt til å amplifisere og samtidig kvantifisere et "target DNA-molekyl". Metoden tillater både deteksjon og kvantifikasjon av en spesifikk sekvens i en DNA prøve. Real-Time PCR har større sensitivitet en vanlig PCR og en trenger veldig lite RNA for å kjøre forsøket, i tillegg vil en ved Real-Time PCR undersøkelser kvantifisere produktet for hver syklus av PCR reaksjonen. For å kvantifisere produktet blir det i de fleste tilfeller brukt en probe. Denne proben vil fluorisere når den binder seg til komplementær DNA når PCR reaksjonen oppformeres. Når reaksjonen er ferdig leses fluorescensen av spektrofluorometrisk og en kan da se hvor mange sykluser som må til før det er påviselige mengder produkt i prøven. En av fordelene med denne typen PCR er at det blir mulig å kvantifisere små konsentrasjoner av mRNA og en kan kvantifisere relativ genekspresjon ved en gitt tid eller i en gitt celle eller vevstype. Real-Time PCR kan brukes til flere ulike analyser og prøver. Noen av disse testene er screening av rogn i settefiskanlegg for å finne eventuelle smittebærende eller infisert rogn. screening av fisk som skal brukes til avl for å detektere sykdom eller finne fisk som viser immunitet, finne ut hvordan genene blir uttrykt eller hvordan forekomsten av potensielle sykdomsutbrudd skjer blandt vill og oppdrettet fisk. I oppdrettsnæringen er Real-time PCR brukt hovedsakelig til å fastslå virussmitte hos fisk som er tilsynelatende frisk. Real-time PCR kan derfor sees på som et viktig profylaktisk tiltak for å unngå å avle på IPNV infisert fisk.
Profylaktiske tiltak mot IPNV
Profylaktiske tiltak betyr forebyggende tiltak. Dette er ting man gjør for å hindre sykdomsutbrudd og sykdomsspredning. Graden av gode profylaktiske tiltak vil være med å bidra til utelukkingen av en del sykdommer, som IPN. Gode profylaktiske tiltak kan være med på å gi oss en enklere vei til diagnosebestemmelse, da vi kan utelukke enkelte faser i prosessen.
• Hygiene og desinfeksjon er to av de viktige profylaktiske tiltakene, det er viktig med klare skiller på rene og skitne soner, og hvilket utstyr man bruker hvor. Dette for å forhindre smitte mellom kar, soner og lokaler. Desinfeksjon av utstyr går også inn i dette. Man flytter ikke rundt på utstyr uten en grundig desinfeksjon først.
• PCR- screening av rogn og stamfisk, for å forhindre smitte fra stamfisk, via rognen og til anlegget. Dette for å sjekke om stamfisken har IPN viruset i seg. Stamfisk med IPNV smitte blir ikke brukt som stamfisk.
• Desinfeksjon av rogn blir gjort i tilfelle rognen får viruset på seg i strykebua. Rogna kan bli smittet ved dårlig desinfeksjon av batchene eller utstyr i strykebua.
• Genforedlet fisk er et tiltak. Fiskens gener blir nøye valgt ut, slik at laksestammer som viser resistens mot IPNV blir valgt til videre avlsarbeid.
• Ved kjøp av rogn fra mer enn en rognprodusent må adskilte kar brukes for å forhindre smitte mellom batchene.
• Det er og viktig å la fisken være ustresset. Dette betyr at man må la fisken/yngelen ha stabile forhold, både temperatur, vannkvalitet og miljømessig. Store variasjoner i dette er ikke bra for stressnivået til fisken. Skadedyrbekjemping er et tiltak mot stress.
• IPNV kan også smitte gjennom fòr som ikke har blitt korrekt bearbeidet og kontrollert hos produsent. Nøye kontroll kan forebygge og utelukke smitte fra fòr.
Referanser
1. «Fiskehelse og fiskesykdommer». Poppe, Trygve. Universitetsforlaget, 2002. ISBN 8200127184
2. «Immunologi og immunologiske teknikker». Lea, T. Fagbokforlaget, 2003. ISBN 82-450-0219-4
Internett-linker
http://www.fiskerifond.no/files/projects/attach/ipnsalmonids.pdf Fiskeri- og havbruksnæringens landsforening. Evensen Ø., Rimstad E., Stagg R., Brun E., Midtlyng P., Skjelstad B., et al. (Oktober 2003). IPN in salmonids, a review
http://www.fiskerifond.no/files/projects/attach/faktaomipn1.pdf Fiskeri- og havbruksnæringens landsforening. Aunsmo A., Garseth Å. H., Maroni K., Evensen Ø. (Januar 2005). Fakta om IPN
http://www.kyst.no/index.php?page_id=59&offset1=25&article_id=75676 Norsk Fiskeoppdrett AS – kyst.no. (22 September 2006). Kan snart vaksinere yngel mot IPN
http://www.imr.no/__data/page/8431/3.3.1_Helsesituasjonen_hos_laksefisk.pdf Institute Of Marine Research. Skjelstad H. R., Bornø G., Flesjå K., Hansen H., Nilsen H., Wasmuth M. A. et al. (2008) Helsesituasjonen hos oppdrettsfisk 2007.
Mal:Mangler interwiki
