HOMO og LUMO
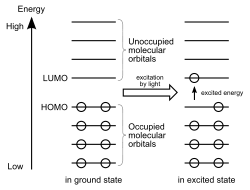


I kjemi er HOMO og LUMO typer molekylære orbitaler. Forkortelsene står for henholdsvis høyest okkupert molekylær orbital og lavest ubebodd molekylær orbital.
HOMO–LUMO gap[rediger | rediger kilde]
Energiforskjellen mellom HOMO og LUMO kalles HOMO–LUMO gap. HOMO og LUMO kalles noen ganger kollektivt grenseorbitaler, slik som i teorien om molekylær orbital. Forskjellen i energi mellom disse to grenseorbitalene kan brukes til å forutsi styrken og stabiliteten til innskuddsmetallkomplekser, så vel som fargene de produserer i løsning.[1]
Halvledere[rediger | rediger kilde]
HOMO-nivået til organiske halvledere er omtrent det maksimale valensbåndet til uorganiske halvledere og kvantepunkter. Den samme analogien kan gjøres mellom LUMO-nivået og ledningsbåndets minimum.[2]
Organometallisk kjemi[rediger | rediger kilde]
I organometallisk kjemi kan størrelsen på LUMO-lappen bidra til å forutsi hvor tillegg til pi-ligander vil forekomme.
SOMO[rediger | rediger kilde]
En SOMO er en enkelt okkupert molekylær bane, for eksempel halvfylt HOMO av en radikal.[3] Denne forkortelsen kan også utvides til semi okkupert molekylær bane.
Tilstøtende orbitaler: NHOMO og SLUMO[rediger | rediger kilde]
Hvis det eksisterer, er det også funnet at molekylære orbitaler på ett energinivå under HOMO og ett energinivå over LUMO spiller en rolle i teorien om molekylær orbital. De blir kalt NHOMO for det nest høyeste okkuperte molekylære orbitalet og SLUMO for det nest laveste ubebodde molekylære orbitalet.[4] Disse blir ofte referert til som henholdsvis HOMO-1 og LUMO + 1.[trenger referanse]
Referanser[rediger | rediger kilde]
- ^ Griffith, J.S. and L.E. Orgel. "Ligand Field Theory". Q. Rev. Chem. Soc. 1957, 11, 381-383
- ^ Bredas, J,-L. "Mind the gap!". Mater. Horiz. 2014,1, 17-19
- ^ Nič, Miloslav, red. (12. juni 2009). «SOMO». IUPAC Compendium of Chemical Terminology (engelsk). IUPAC. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.s05765. Besøkt 4. februar 2021.
- ^ Nič, Miloslav, red. (12. juni 2009). «subjacent orbital». IUPAC Compendium of Chemical Terminology (engelsk). IUPAC. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.s06067. Besøkt 4. februar 2021.
