Megakaryocytter
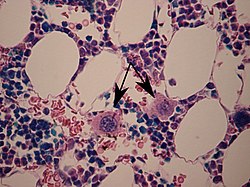
Megakaryocytter (uttale: megakaryoc′ytter), også kjent som megalokaryocytter, er store celler som hovedsakelig er lokalisert i beinmargen. Her utgjør de 0,05–0,1 % av cellepopulasjonen.[1] Et lavt antall megakaryocytter kan også bli funnet i milten, leveren og lungene.[2] Megakaryocyttene er meget spesialiserte celler, hvis eneste kjente funksjon er å produsere blodplater (trombocytter). En megakaryocytt kan produsere opptil 4000 blodplater i løpet av sin levetid, men de fleste produserer mellom 1000 og 3000 blodplater. Hos mennesker blir det produsert rundt 1 x 10^11 blodplater hver dag, et antallet som kan økes ved behov.[3]
Morfologi[rediger | rediger kilde]
Megakaryocytter har fått navnet sitt på grunn av den store kjernen de har. Ordet kommer fra gresk mega («stor»), karyon («kjerne») og kytos («celle»). Undersøker man megakaryocytter i mikroskop kan man få inntrykk av at de er utstyrt med flere kjerner. Dette er ikke riktig, de har bare én stor, lobulær og polyploid kjerne. Megakaryocyttene er opptil 15 ganger større enn andre blodceller. De har en diameter som ligger mellom 20 og 100 mikrometer, hvorav de fleste ligger mellom 30-70 mikrometer, og har et volum som vanligvis ligger rundt 4700 ± 100 femtoliter.[2][4] Cytoplasmaen er meget organisert og inneholder et avansert membransystem, kalt for DMS (fra engelsk demarcation membrane system). Dette systemet inneholder et membran-reservoar som er nødvendig for dannelsen av nye plater.[5] Andre strukturer, som også er tilstede i blodplatene de produserer, er ulike granuler. Granulene inneholder både protein som megakaryocyttene selv har produsert (for eksempel P-selectin, plate faktor 4, beta-thrombo-globulin, von Willebrand faktor) og proteiner som de har tatt opp fra plasma ved endocytose og pinocytose (for eksempel fibrinogen).[6][7] Ved aktivering av blodplatene slippes innholdet ut fra granulene og bidrar til hemostasen.
Historie[rediger | rediger kilde]
Megakaryocyttene ble beskrevet for første gang i 1969 av den italienske legen og forskeren Giulio Bizzozero.[8] Han undersøkte de ulike cellene i beinmargen ved mikroskopering da han la merke til noen celler som var mye større enn de andre. Disse cellene hadde store og lobulære kjerner. Hans tegninger er for oss i dag lett gjenkjennelige som megakaryocytter.[9] Bizzozero er også kjent for å ha identifisert blodplatenes rolle i hemostasen, men det var den amerikanske patologen James Homer Wright som i 1906 oppdaget at megakaryocyttene står bak selve produksjonen av blodplatene.[10][11] Wright hadde utviklet en ny metode for å undersøke ulike celler og deres strukturer ved å bruke en blanding av eosin og metylenblått. Slik oppdaget han at det var store likheter mellom noen granuler som var tilstede i både megakaryocytter og plater, og som ved hans metode ble farget rød-lilla. 4 år senere viste Wright at megakaryocyttene danner utstikkere og at platene blir dannet fra disse.[12]
Megakaryocytopoiese – dannelse av megakaryocytter[rediger | rediger kilde]
Megakaryocyttene oppstår fra haemopoetiske stamceller ved en prosess som kalles megakaryocytopoiese. Under megakaryocytopoiesen modnes megakaryocyttene ved at de øker i størrelse, øker sitt DNA-innhold og begynner å uttrykke trombotiske markører.[13] Denne prosessen involverer proliferasjon, terminal differensiering og til slutt modning. Dette gjør megakaryocyttene i stand til å produsere blodplater.[14] Megakaryocyttene dannes av haemopoetiske stamceller ved å følge denne linjen: CFU-GEMM → BFU-Meg → CFU-Meg → promegakaryoblast → megakaryoblast → promegakaryocyte → megakaryocyte.[15]
I slutten av proliferasjonsfasen mister de umodne forløperne til megakaryocyttene evnen til å dele seg. Dette markerer overgangen til den terminale differensieringen, der de gjennomgår en modifisert form for cellesyklus kalt endomitose. I endomitosefasen gjennomgår cellene M-fasen, men ikke anafase B, telofase og cytokinese.[16][17] Denne spesielle formen for cellesyklus resulterer i at megakaryocyttene blir polyploide, det vil si at de har mer enn to homologe sett med kromosomer. Megakaryocyttene kan gjennomgå endomitose opptil 6 ganger, men det fleste gjennomgår 3 endomitoser og ender dermed opp med et DNA-innhold på 16N.[15] Grunnen til at megakaryocyttene er polyploide er sannsynligvis at dette amplifiserer antall gener og dermed øker protein-syntesen.[18] Denne økte protein-syntesen kan være en fordel like etter endomitosen, da megakaryocyttene gjennomgår en fase med rask vekst. Her blir DMS dannet og cytoplasmiske proteiner og granuler som er essensielle for platenes funksjon blir akkumulert.[15] Megakaryocytopoiese er en meget kompleks prosess og dens siste steg, modning, foregår i spesialiserte nisjer i beinmargen, kalt vaskulære nisjer.[19] De modne megakaryocyttene er nå klare til å produsere plater, en prosess som kalles trombopoiese.
Trombopoiese – produksjon av plater[rediger | rediger kilde]

De modne megakaryocyttene posisjonerer seg inntil vaskulære endotelceller i beinmargen, og danner lange forgreininger som blir kalt pro-plater.[14] Disse pro-platene føres så inn mellom de vaskulære endotelcellene og inn i lumen av blodårene. Ved hjelp av styrken i blodstrømmen blir pro-platene fragmentert, noe som fører til at nydannede plater slippes ut og skylles av gårde med blodet.[20] Både megakaryocytopoiesen og trombopoiesen er nøye regulert av en rekke faktorer. En av de viktigste proteinene er thrombopoietin (THPO, TPO). Thrombopoietin er en vekstfaktor som blir produsert av leveren og som er nødvendig i alle steg av megakaryocytopoiesen.[21] Ved å binde til en reseptor på overflaten av megakaryocyttene som heter MPL setter den i gang intracellulære signaliserings-kaskader. Disse signalene fører så til utvikling av megakaryocyttene og produksjon av blodplater ved hjelp av diverse transkripsjonsfaktorer. Ved redusert antall blodplater i sirkulasjonen, for eksempel som følge av sykdom, øker nivået av thrombopoietin i plasma for å stimulere til økt produksjon av blodplater.[22]
Sykdommer som involverer megakaryocytter[rediger | rediger kilde]
Megakaryocytter er involvert i en rekke sykdommer, enten ved at de er kvantitativt og/eller kvalitativt endret som en del av selve sykdomsbildet, eller ved at de blir påvirket av medisinsk behandling. Hos pasienter med idiopatisk eller immun trombocytopenia purpura (ITP) er antall sirkulerende blodplater redusert i varierende grad. Studier har vist at dette kan skyldes økt destruksjon av blodplater, men også lavere produksjon av blodplater i beinmargen. Den lavere produksjonen av blodplater kan skyldes redusert megakaryocytopoiese samt økt apoptose i megakaryocytt-populasjonen.[23][24] Lavt antall blodplater (trombocytopenia) er en vanlig bi-effekt ved kjemoterapi etter kreftbehandling, og er assosiert med økt blødning hos pasienten. Studier har vist at kjemoterapi kan ødelegge umodne megakaryocytter i differensierings-fasen, noe som kan være med å forklare den hyppige forekomsten av trombocytopenia hos disse pasientene.[25] Videre har det hos kreftpasienter med metastaser i lungene blitt funnet høyere antall megakaryocytter i lungene enn normalt, men betydningen av dette er uklar.[26] Det har også blitt rapportert at HIV kan føre til strukturelle endringer hos, og nedgang i antall av, megakaryocytter.[27][28] Det kan være utfordrende å forske på megakaryocyttene på grunn av deres lave antall, avanserte modningsprosess og det faktum at de hovedsakelig er lokalisert i beinmargen. Etter hvert som våre forskningsmetoder utvikler seg og blir bedre, er det ventet at flere av megakaryocyttenes hemmeligheter blir avslørt. Dette kan føre til bedre forståelse og behandling av sykdommer der disse spesielle cellene er involvert.
Referanser[rediger | rediger kilde]
- ^ Huang H, Cantor AB. Common features of megakaryocytes and hematopoietic stem cells: what's the connection? J Cell Biochem. 2009;107:857-64.
- ^ a b Sun L, Hwang WY, Aw SE. Biological characteristics of megakaryocytes: specific lineage commitment and associated disorders. Int J Biochem Cell Biol. 2006;38:1821-6.
- ^ Branehog I, Ridell B, Swolin B, Weinfeld A. Megakaryocyte quantifications in relation to thrombokinetics in primary thrombocythaemia and allied diseases. Scand J Haematol. 1975;15:321-32.
- ^ Harker LA, Finch CA. Megakaryocyte biology and the production of platelets. J Clin Invest. 1969;48.
- ^ Schulze H, Korpal M, Hurov J, Kim SW, Zhang J, Cantley LC, et al. Characterization of the megakaryocyte demarcation membrane system and its role in thrombopoiesis. Blood. 2006;107:3868-75.
- ^ Handagama PJ, Bainton DF. Incorporation of a circulating protein into alpha granules of megakaryocytes. Blood Cells. 1989;15:59-72.
- ^ Handagama PJ, George JN, Shuman MA, McEver RP, Bainton DF. Incorporation of a circulating protein into megakaryocyte and platelet granules. Proc Natl Acad Sci U S A. 1987;84:861-5.
- ^ Bizzozero G. Sul midollo della ossa. Il Morgagni. 1869.
- ^ Baserga A. The hematologic work of Giulio Bizzozero. Sci Med Ital. 1958;7:45-63.
- ^ Bizzozero G. Su di un nuovo elemento morfologico del sangue dei mammiferi e della sua importanza nella trombosi e nella coagulazione. L´Osservatore. 1881:785 - 7.
- ^ Wright J. The origin and nature of blood platelets. Boston Med Surg J. 1906;154:643-5.
- ^ Wright DG. The histogenesis of the blood platelets. J Morphol. 1910;21.
- ^ Beaulieu LM, Freedman JE. The role of inflammation in regulating platelet production and function: Toll-like receptors in platelets and megakaryocytes. Thromb Res.125:205-9.
- ^ a b Deutsch VR, Tomer A. Advances in megakaryocytopoiesis and thrombopoiesis: from bench to bedside. Br J Haematol.
- ^ a b c Michelson AD. Platelets. 2 ed. Oxford, UK.: Elsevier Inc.; 2007.
- ^ Takayama N, Eto K. Pluripotent stem cells reveal the developmental biology of human megakaryocytes and provide a source of platelets for clinical application. Cell Mol Life Sci.69:3419-28.
- ^ Ravid K, Lu J, Zimmet JM, Jones MR. Roads to polyploidy: the megakaryocyte example. J Cell Physiol. 2002;190:7-20.
- ^ Raslova H, Roy L, Vourc'h C, Le Couedic JP, Brison O, Metivier D, et al. Megakaryocyte polyploidization is associated with a functional gene amplification. Blood. 2003;101:541-4.
- ^ Psaila B, Lyden D, Roberts I. Megakaryocytes, malignancy and bone marrow vascular niches. J Thromb Haemost.10:177-88.
- ^ Junt T, Schulze H, Chen Z, Massberg S, Goerge T, Krueger A, et al. Dynamic visualization of thrombopoiesis within bone marrow. Science. 2007;317:1767-70.
- ^ de Sauvage FJ, Hass PE, Spencer SD, Malloy BE, Gurney AL, Spencer SA, et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature. 1994;369:533-8.
- ^ Kaushansky K. Thrombopoietin: basic biology and clinical promise. Leukemia. 1997;11 Suppl 3:426-7.
- ^ McMillan R, Nugent D. The effect of antiplatelet autoantibodies on megakaryocytopoiesis. Int J Hematol. 2005;81:94-9.
- ^ Houwerzijl EJ, Blom NR, van der Want JJ, Esselink MT, Koornstra JJ, Smit JW, et al. Ultrastructural study shows morphologic features of apoptosis and para-apoptosis in megakaryocytes from patients with idiopathic thrombocytopenic purpura. Blood. 2004;103:500-6.
- ^ Zeuner A, Signore M, Martinetti D, Bartucci M, Peschle C, De Maria R. Chemotherapy-induced thrombocytopenia derives from the selective death of megakaryocyte progenitors and can be rescued by stem cell factor. Cancer Res. 2007;67:4767-73.
- ^ Soares FA. Increased numbers of pulmonary megakaryocytes in patients with arterial pulmonary tumour embolism and with lung metastases seen at necropsy. J Clin Pathol. 1992;45:140-2.
- ^ Zauli G, Catani L, Gibellini D, Re MC, Vianelli N, Colangeli V, et al. Impaired survival of bone marrow GPIIb/IIa+ megakaryocytic cells as an additional pathogenetic mechanism of HIV-1-related thrombocytopenia. Br J Haematol. 1996;92:711-7.
- ^ Zucker-Franklin D, Termin CS, Cooper MC. Structural changes in the megakaryocytes of patients infected with the human immune deficiency virus (HIV-1). Am J Pathol. 1989;134:1295-303.
