Komplekstitrering
Komplekstitrering er en kjemisk analysemetode der en bruker den evnen visse molekyler (ligander) har til å danne komplekser. Dette kan for eksempel brukes til å finne konsentrasjonen av metallioner i en prøveløsning (f. eks. drikkevann). Man tilsetter en ligand dråpevis til prøveløsningen, til alt metallet er bundet i komplekser.
For å kunne observere omslagspunktet, der mengden analysevæske (reagens) balanserer mengden metallioner (ekvivalenspunktet), brukes en indikator som har én farge så lenge det finnes metallioner i løsningen, og en annen farge når alt metallet er bundet i komplekser. Indikatoren skifter altså farge i omslagspunktet. Man måler da hvor mye analysevæske som er brukt til omslagspunktet, og kan dermed beregne hvor mye metall det er i vannet.
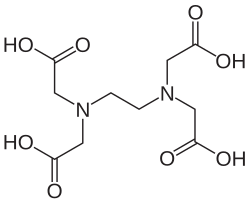
Komplekstitrering blir ofte brukt til å bestemme innholdet av kalsium (Ca) og magnesium (Mg) i vann. Summen av mengde kalsium og magnesium er et mål på vannets hardhet. En mye brukt ligand for å bestemme hardheten i vann, er EDTA (etylendiamintetraacetat).[1]
Som indikator brukes indikatoren eriokromsvart-T som er rød så lenge det er Ca2+ til stede, men skifter farge til blå når det tilsettes EDTA etter ekvivalenspunktet (også kalt endepunktet[1]). Det som er nevnt om kalsium om EDTA gjelder også for magnesium. Titrer vi derfor en blanding av kalsium og magnesium bestemmer vi dermed summen av de to ionene.
EDTA er en fireprotisk syre (kan spalte av 4 H+) og kan forkortes H4Y. Om den spalter av ett, to, tre eller fire protoner er avhengig av pH-verdien i løsningen. Ved komplekstitrering av kalsium skal pH-verdien ligge på rundt 9-10. Dette fås ved å bruke en NH4Cl/NH3 buffer. Med pH på rundt 9-10 dominerer HY3-. Reaksjonen mellom HY3- og f.eks. Ca2+ er:
HY3-(aq) + Ca2+(aq) → CaY2-(aq) + H+(aq)
Referanser[rediger | rediger kilde]
- ^ a b Kjemien stemmer. Oslo: Cappelen. 1998. s. 190-191. ISBN 8202172462.
