Sigma-binding

I kjemi er sigma-bindinger (σ-bindinger) den sterkeste typen kovalente bindinger.[1] De dannes ved frontoverlapping mellom atomorbitaler. Sigma-binding er enklest definert for diatomiske molekyler ved å bruke språket og verktøyene til symmetrigrupper. I denne formelle tilnærmingen er en σ-binding symmetrisk med hensyn til rotasjon rundt bindingsaksen. Ved denne definisjonen er vanlige former for sigmabindinger s+s, pz+pz, s+pz og dz2+dz2 (hvor z er definert som aksen til bindingen eller den internukleære aksen).[2] Kvanteteori indikerer også at molekylære orbitaler (MO) med identisk symmetri faktisk blander eller hybridiserer. Som en praktisk konsekvens av denne blandingen av diatomiske molekyler, blir bølgefunksjonene s+s og pz+pz molekylære orbitaler blandet. Omfanget av denne blandingen (eller hybridiseringen eller blandingen) avhenger av de relative energiene til MO-ene med lik symmetri.
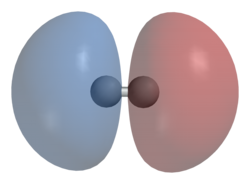
For homodiatomisk (homonukleære diatomiske molekyler) har bindende σ-orbitaler ingen nodalplan der bølgefunksjonen er null, enten mellom de bundne atomene eller passerer gjennom de bundne atomene. Den tilsvarende antibindingen, eller σ* orbitalen, er definert av tilstedeværelsen av ett nodalplan mellom de to bundne atomene.
Sigmabindinger er den sterkeste typen kovalente bindinger på grunn av den direkte overlappingen av orbitalen, og elektronene i disse bindingene blir noen ganger referert til som sigmaelektroner.[3]
Symbolet σ er den greske bokstaven sigma. Når det sees nedover bindingsaksen, har en σ MO en sirkulær symmetri, og ligner derfor en på en «s» atomorbital.
Vanligvis er en enkeltbinding en sigmabinding mens en multippelbinding er sammensatt av en sigmabinding sammen med pi eller andre bindinger. En dobbeltbinding har én sigma pluss én pi-binding, og en trippelbinding har én sigma pluss to pi-bindinger.
Referanser[rediger | rediger kilde]
- ^ Moore, John W. (2010). Principles of chemistry : the molecular science. Belmont, Calif.: Brooks/Cole Cengage Learning. ISBN 978-0-495-39079-4. OCLC 236319511.
- ^ Clayden, Jonathan (2012). Organic chemistry (2nd ed utg.). Oxford: Oxford University Press. s. 101–131. ISBN 978-0-19-927029-3. OCLC 761379371.
- ^ Keeler, James (2008). Chemical structure and reactivity : an integrated approach. Oxford: Oxford University Press. s. 27–46. ISBN 978-0-19-928930-1. OCLC 214305974.
