Diamant
| Diamant | |
|---|---|
 Brušeni diamanti (brilijanti) | |
| Splošno | |
| Kategorija | Naravni mineral |
| Kemijska formula | C |
| Lastnosti | |
| Molekulska masa | 12,01 g/mol |
| Barva | Najpogosteje rumena, rjava ali siva do brezbarvna. Manj pogosto modra, zelena, črna, prosojno bela, rožnata, vijolična, oranžna, škrlatna in rdeča. |
| Kristalni habit | Oktaedrični |
| Kristalni sistem | Izometrično-heksoktaedrični (kubični) |
| Razkolnost | 111 (popolna v štirih smereh) |
| Lom | Školjkasti |
| Trdota | 10 |
| Sijaj | Diamantni |
| Barva črte | Brezbarvna |
| Prozornost | Prozoren do polprozoren in prosojen |
| Specifična teža | 3,52±0,01 |
| Gostota | 3,5–3,53 g/cm3 |
| Sijaj površine | Diamantni |
| Optične lastnosti | Izotropen |
| Lomni količnik | 2,418 (at 500 nm) |
| Dvolomnost | Nič |
| Pleohroizem | Nič |
| Disperzija | 0,044 |
| Tališče | 3915 K (3642 °C) |
| Sklici | [1] |
Mineral diamant (starogrško αδάμας: adámas - neukrotljiv) je kristalinična oblika oziroma alotropna modifikacija elementa ogljika (druge oblike elementarnega ogljika so grafit, fuleren in grafen). Je eden najbolj znanih in najuporabnejših izmed več kot 3.000 znanih mineralov. Diamanti slove po svojih izstopajočih fizikalnih lastnostih, posebno trdoti (to nakazuje tudi izvor besede) ter visoki lomnosti svetlobe. Te in druge lastnosti uvrščajo diamant med najuporabnejše minerale v draguljarstvu in v številnih panogah industrije. Dolgo je veljal za najtršo naravno snov, danes pa ni več tako. Znanstveniki so na dnu kraterjev odkrili rudnino lonsdaleit, ki je kar 58% trša od diamanta. Nastane med padcem meteorita, ko se preoblikuje in utrdi pod izjemno velikim tlakom.
Večino diamantov izkopljejo iz ognjeniških žil, kamor so jih odložili ognjeniki globokega izvora. Ti so črpali material iz globin, prek 150 km oddaljenih od zemeljskega površja, kjer so bili primerni temperaturni in tlačni pogoji za nastanek diamantov.
Večino diamantov danes izkopljejo v osrednji in južni Afriki, pomembna nahajališča pa so tudi v Kanadi, Rusiji, Braziliji in v Avstraliji. Letno jih izkopljejo okrog 130 milijonov karatov (26.000 kg) s skupno vrednostjo blizu 9 milijard USD. Dodatno izdelajo še skoraj štirikrat toliko umetnih diamantov. Kanadski iskalci diamantov so našli doslej največje naravne diamante v velikih žrelih ugaslih vulkanov na zaledenelem severu Kanade. Napovedujejo da bo do leta 2012 Kanada postala največja dobaviteljica naravnih diamantov na svetu[navedi vir].
Privlačnost diamantov kot draguljev je v njihovi trdoti in optičnih lastnostih. Diamanti, uporabljeni kot dragulji, so rezani, njihove ploskve pa nato zglajene v številne brušene oblike, ki naj bi poudarile njihove dobre lastnosti. Trdota diamantov omogoča, da odlično prenašajo glajenje in se upirajo razenju (diamant lahko razi le drug diamant). To jim daje izjemen lesk. Lom bele svetlobe v mavrico barv, ki je poznana kot ogenj, je druga osnovna značilnost teh draguljev, ki je bila že tekom zgodovine zelo cenjena.
Diamante kot dragulje ocenjujemo po masi, jasnosti, barvi in rezu. Ljudje jih cenimo že približno poltretje tisočletje. Že pred toliko časa so jih v Indiji uporabljali v verskih podobah. Njihova priljubljenost je narasla v 19. stoletju, ko so se pojavili novi načini rezanja, ki so še bolj poudarjali kakovost teh dragih kamnov.
Industrijska uporaba diamantov se je v svoji zgodovini, ki prav tako sega daleč v preteklost, povezala z njihovo trdnostjo. Zaradi te lastnosti je diamant najprimernejši material za rezalna in brusilna orodja. Običajno so diamanti nanešeni na rezalne ploskve žag in svedrov, kot brusilno sredstvo pa se uporablja diamantni prah. V razvoju so ali pa že obstajajo tudi druge možnosti uporabe diamantov. Tako se so nekateri modri diamanti - za razliko od večine ostalih, ki so odlični izolatorji - naravni polprevodniki. V industriji uporabljajo diamante, ki so neprimerni za uporabo v draguljarstvu, ali pa so umetno izdelani, kar zniža njihovo ceno in njihovo uporabo naredi gospodarnejšo.
Izdelovanje in razpečevanje diamantov je v glavnem v rokah nekaj večjih podjetij. Ti posli potekajo v tradicionalnih središčih za trgovino z njimi (najpomembnejši je Antwerpen v Belgiji). Skupina De Beers, ki ima sedež v južnoafriškem Johannesburgu in v Londonu, je v poslu z diamanti glavna že prek 100 let. Podjetje ima skupaj s podružnicami v lasti rudnike, ki dajo okrog 40 % letne proizvodnje diamantov, obenem pa obvladujejo prodajne poti, po katerih letno potuje skoraj dve tretjini vseh diamantov, uporabljenih v draguljarstvu.
Ker je skupina De Beers skozi zgodovino razvila postopke z monopolističnimi značilnostmi, denimo strog nadzor nad zalaganjem in domnevno manipuliranje s cenami diamantov, poleg tega pa so jih nekateri afriški revolucionarji prodajali, da bi dobili sredstva za svoje nasilno ravnanje, imajo diamanti delno sporen sloves.
Diamantne kamnine[uredi | uredi kodo]
Kamnine, v katerih najdemo diamante, prihajajo iz velikih zemeljskih globin, so bolj redke. Med najbolj znanimi so; kimberlit, lamproit, harzburgit in eklogit. Vsebnost diamantov v teh kamninah je zelo nizka, ne presega 1 %. Tudi ta količina vsa ne dosega draguljarske kakovosti. Diamant brez primesi je brezbarven, kadar pa ima majhne vsebnosti drugih kemičnih prvin, se lahko obarva raznobarvno. Tako nastanejo barvni ali fantazijski diamanti, med njimi so najredkejši modri, zeleni in rdeči diamanti. Bolj pogosto najdemo rožnate, rumene, sive in črne diamante, ki so tudi mnogo cenejši.
Kemijske lastnosti[uredi | uredi kodo]
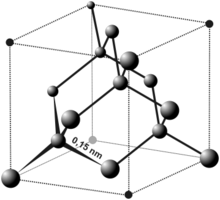
Diamant je kovalenten kristal ogljika. Ogljikovi atomi so med seboj povezani z močnimi kovalentnimi vezmi. Razporejeni so tetrično, torej ima med vezmi kot 109,5°. Ker nima nevezanih elektronov, ne prevaja električnega toka.
Materialne lastnosti[uredi | uredi kodo]


Diamant je prozoren kristal, v katerem tetrahedrsko povezani atomi ogljika oblikujejo kovalentno povezano mrežo (sp3, ki kristalizira kot varianta FCC strukture. Diamanti se zaradi njihovih izjemnih fizikalnih lastnosti uporabljajo za številne namene. Najbolj znani sta skrajna trdota diamanta in njegova toplotna prevodnost(900–2320 W·m−1·K−1),[2] pa tudi velik razmik pasov (bandgap) in možna optična disperzija. Nad1700 °C (1973 K / 3583 °F) v vakuumu ali atmosferi brez kisika se diamant pretvori v grafit; na zraku se pretvorba prične pri ~700 °C.[3] Vžigna temperatura diamanta je 720 – 800 °C v kisiku in 850 – 1000 °C na zraku.[4] Naravbni diamanti imajo gostoto 3.15–353 g/cm3, čisti diamant je pri tem blizu 352 g/cm3.[5] Kemijske vezi med atomi ogljika v diamantu so šibkejše od vezi v grafitu. V diamantu tvorijo vezi togo tridimenzionalno rešetko, v grafitu pa so atomi tesno vezani v liste, ki z lahkoto drsijo drug prek drugega, tako da je celotna struktura šibkejša.[6]
Opombe in sklici[uredi | uredi kodo]
- ↑ »Diamond«. WebMineral. Pridobljeno 7. julija 2009.
- ↑ Wei, L.; Kuo, P. K.; Thomas, R. L.; Anthony, T.; Banholzer, W. (1993). »Thermal conductivity of isotopically modified single crystal diamond«. Physical Review Letters. 70 (24): 3764–3767. Bibcode:1993PhRvL..70.3764W. doi:10.1103/PhysRevLett.70.3764. PMID 10053956.
- ↑ John, P; Polwart, N.; Troupe, C.E.; Wilson, J.I.B. (2002). »The oxidation of (100) textured diamond«. Diamond and Related Materials. 11 (3–6): 861. Bibcode:2002DRM....11..861J. doi:10.1016/S0925-9635(01)00673-2.
- ↑ »Basic Properties of Diamond«. DiamondBladeSelect.com.
- ↑ »Diamond«. Mindat. Pridobljeno 7. julija 2009.
- ↑ Gray, Theodore (september 2009). »Gone in a Flash«. Popular Science: 70.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava)
Viri[uredi | uredi kodo]
- Miha Jeršek, Meta Dobnikar, Franc Arbeiter- Dragulji, Založba Narava- Prirodoslovni muzej Slovenija, Kranj 2005.
Glej tudi[uredi | uredi kodo]
Zunanje povezave[uredi | uredi kodo]
- World of diamonds (eng)
- 5000+ pages historical references Diamonds Robert Boyle, Albertus Magnus, Theophrastus etc.
