리튬
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Lithium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준 원자량 (Ar, standard) | [6.938, 6.997] 6.94 (보편) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | 1족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 2주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | s-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 알칼리 금속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 배열 | 1s2 2s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 준위별 전자 수 | 2, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 은백색, 회색 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 453.69 K 180.50 °C 356.90 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | 1615 K 1330 °C 2426 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | 0.534 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 임계점 | 3220 K, 67 MPa (추정) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 3.00 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 136 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | 24.860 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | +1 (강한 염기성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 0.98 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 152 pm (실험값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 128±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 판데르발스 반지름 | 182 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 체심 입방정계 (bcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 음속 (얇은 막대) | 6000 m/s (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 46 µm/(m·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 84.8 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 저항도 | 92.8 n Ω·m (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기 정렬 | 상자성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 영률 | 4.9 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전단 탄성 계수 | 4.2 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 부피 탄성 계수 | 11 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스 굳기계 | 0.6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7439-93-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
리튬(영어: Lithium 리시엄[*], 문화어: 리티움←독일어: Lithium 리티움[*])은 알칼리 금속에 속하는 화학 원소로, 기호는 Li(←라틴어: Lithium 리티움[*])이고 원자 번호는 3이다. 돌을 뜻하는 그리스어 리토스(λίθος, líthos)에서 이름이 유래되었는데, 이유는 나트륨이나 칼륨과는 달리 광석에서 처음으로 발견했기 때문이다. 무르고 은백색이며 부식을 유발한다. 합금으로 열전달이나 전지 등에 사용할 수 있으며, 미네랄 오일에는 리튬 염의 형태로 첨가되어 있는 경우가 많다. 하얀 석유라고 불린다.
역사[편집]

리튬이 포함된 엽장석(葉長石, petalite)은 브라질의 학자인 조제 보니파시우 데 안드라다 에 시우바(José Bonifácio de Andrada e Silva)가 18세기 말에 발견하였다. 1817년, 스웨덴의 요한 아우구스트 아르프벳손(Johan August Arfwedson)은 우퇴 섬(Utö)에서 발견한 리튬휘석(spodumene, (LiAl[(SiO3)2])과 운모(雲母, K(Li,Al)3[(Al,Si)4O10](F,OH)2)를 분석하던 중 리튬의 존재를 확인하게 되었다. 1818년, 독일의 화학자 크리스티안 고틀로프 그멜린(Christian Gottlob Gmelin)은 리튬 염들을 가열하면 화염이 붉은 색으로 변한다는 것을 알아내었다. 이후 아르프벳손과 그멜린은 리튬을 광석에서 유리시키려는 시도를 했지만 성공하지 못했고, 대신 같은 해에 영국에서 윌리엄 토머스 브란드(William Thomas Brande)와 험프리 데이비(Sir Humphry Davy)가 산화 리튬(Li2O)의 전기 분해를 통해 순수한 리튬을 얻는 데에 성공했다.
1855년, 로베르트 분젠(Robert Bunsen)과 오거스터스 매티슨(Augustus Matthiessen)은 염화 리튬(LiCl)의 전기 분해로 더 많은 양의 순수 리튬을 추출하는 방법을 터득했고, 1917년, 빌헬름 솅크(Wilhelm Schenk)는 유기 수은 화합물에서 최초의 유기 리튬 화합물을 합성했다.[1] 1923년에는 독일 금속회사(Deutsche Metallgesellschaft, 오늘날의 GEA Group)가 염화 리튬과 염화 칼륨(KCl)의 용액을 전기 분해하는 방법을 사용해 리튬의 상업적 생산을 시작했다.
2차 대전 직후까지 리튬은 대부분 윤활제로나 유리 공업에서만 쓰였는데, 미국이 리튬을 통해 획득할 수 있는 삼중수소를 수소 폭탄의 제조에 필요로 하게 되자 상황이 급변했다. 산출량은 급격히 증가했고, 노스캐롤라이나주의 킹스 마운튼(Kings Mountain)이 특히 중요한 산출 지역이 되었다.[2] 삼중수소의 짧은 반감기를 의식했기 때문에 1953년부터 1963년까지 리튬은 대량으로 비축되었고[2], 이는 냉전이 끝난 1993년부터 시장으로 유통되기 시작했다.
2007년부터는 리튬 전지의 제조가 가장 중요한 용도로 정착되었으며[3], 소금물의 비교적 저렴한 생산이나 채광업에도 역시 중요한 역할을 한다.
존재[편집]
지구 내[편집]

지각의 리튬 함유량은 0.006%으로[4], 아연, 구리, 텅스텐보다는 조금 적으며, 코발트, 주석, 납보다는 조금 더 많다.
리튬은 높은 반응력 때문에 순수한 형태로는 자연 내에서 발견하기가 무척 힘들다.
리튬은 몇 가지 광물에 포함되어 있다. 가장 중요한 예로는 리튬 함유량이 최대 9%인 인반석(燐磐石, LiAlPO4F)과 역시 함유량이 비교적 높은 리튬휘석, 운모, 엽장석을 들 수 있다. 덜 흔한 예로는 리튬 함유량이 광물 중에서 제일 높은 빙인운모(氷鱗雲母, cryolithionite, Li3Na3(AlF6)2)나 리티오필라이트(lithiophilite, Li(FeII,MnII)[PO4]), 진왈다이트(zinnwaldite, K(Li,Fe,Al)3[(Al,Si)4O10](F,OH)2)가 있다. 리튬 광물은 많은 규산염 암석에서 발견할 수 있으나, 많은 양이 함유되어 있지는 않으며, 큰 노천 광산도 없다. 리튬을 이들 광물에서 추출하는 작업은 매우 번거로우므로 오늘날에는 리튬이나 리튬 화합물을 구할 때 더 이상 이렇다 할 역할을 하지 않으며, 캐어낸 광물을 갈아서 유리 공업에 사용하는 일은 아직도 있다. 리튬의 비축량은 1300만 톤 이상으로 추정된다.[5]
리튬 염 중에서도 특히 염화 리튬(LiCl)은 염호(鹽湖)의 소금물에 최대 1%가 함유되어 있다. 비교적 많은 양의 리튬을 얻을 수 있는 곳은 볼리비아(데 우유니 염호, Salar de Uyuni)[6], 칠레(데 아타카마 염호, Salar de Atacama), 아르헨티나, 미국(노스캐롤라이나와 네바다주), 캐나다, 오스트레일리아, 짐바브웨, 중국(티베트, 차카 염호(扎布耶盐湖, Chabyêr Caka))에 있다. 한국이나 유럽에는 리튬 광산이나 염호가 없으나, 한국의 경우 지질자원연구원이 바닷물에서 리튬을 체광하는 기술을 확보했다.[7]
가장 중요한 리튬 수입원은 탄산 칼륨과 붕사(硼砂, borax)를 얻을 때 남는 리튬 염이다.
지구 바깥[편집]
빅뱅 이후 수소와 헬륨 외에도 7Li의 상당량이 만들어졌으나, 항성 내에서 리튬과 수소 사이에 일어난 양성자-양성자 연쇄 반응 PP II에 의해 더 무거운 원소로 변화하면서 현재까지 대부분이 사라졌다.[8] 갈색 왜성의 경우는 수소의 핵융합을 불러일으키기에 필요한 75 목성 질량(1,8986·1027)에 미달하고 온도도 충분히 높지 않은 까닭에 빅뱅으로 탄생한 리튬을 현재까지도 제대로 보존하고 있다. 따라서 리튬은 지구 외부에서는 흔하지 않은 축에 들고 갈색 왜성의 존재를 규명하는 데 쓰일 수 있다.[9]
별들은 질량, 나이, 중원소 함량이 비슷하더라도 리튬 분포에서는 차이가 많이 날 수 있는데, 이는 행성의 유무와 관계가 있다. 주위에 행성이 없으면 리튬의 함량이 높고, 반대로 태양과 같이 행성을 가질 경우 함량은 줄어든다.[10]
리튬의 추출[편집]
리튬을 포함하는 소금물에서 물을 증발시키고 탄산 나트륨을 첨가해 탄산 리튬을 얻는다. 이때 소금물을 리튬 함유량이 0.5%를 초과할 때까지 농축하며, 물에 잘 녹지 않는 탄산 리튬을 건져낸다.
- .
2008년 미국 이외의 곳에서는 27,400톤의 리튬 광물이 채광되었는데[5], 이의 대다수는 탄산 리튬이었으며, 약 12,000톤은 칠레에서, 7000톤 정도는 오스트레일리아의 광산에서 산출되었다.
리튬 금속을 합성하려면 탄산 리튬을 염산과 섞는다. 이산화 탄소는 기체로 흩어지고 염화 리튬이 용해된 상태로 남는다. 이 용액을 진공 증발기 내에서 염화물이 결정체가 될 때까지 농축한다.
소금물은 부식성이 매우 강하기 때문에, 염화 리튬을 얻을 때 쓰는 도구들은 특수한 강철이나 니켈로 만들어진 것이어야 한다. 352 °C에서 녹게 되는 52%가 염화 리튬, 48%가 염화 칼륨으로 이루어진 공융(共融) 혼합물(eutectic mixture)을 물 대신 녹은 설탕을 전해물로 사용한 전기 분해로 순수 리튬을 유리한다.
또는:
- .
전극전위가 더 높은 칼륨은 여기서 같이 분리되지 않으나, 미량의 나트륨이 섞이게 되며, 이는 리튬을 강한 반응제로 만든다. 이런 리튬은 유기화학용으로는 도움이 되나 리튬 전지용으로는 질이 떨어진다. 전해질의 표면에 모이는 액체 리튬은 전해전지에서 내보내기가 비교적 수월하다. 이외에도 염화 리튬을 피리딘 속에서 전기 분해하는 방법이 있으며, 실험실에서 시험하기에 적당하다.
이차 전지인 리튬 이온 전지는 휴대전화, 노트북 컴퓨터의 전원으로 사용된다.
속성[편집]
물리적 속성[편집]
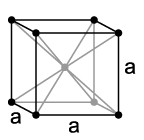
리튬은 상온 상태에서는 가장 가벼운 고체(밀도: 0,534 g/cm3)[12]로 -260 °C에서 고체를 형성하는 수소만이 더 가볍다(밀도: 0,0763 g/cm3)[12]. 리튬은 다른 알칼리 금속과 마찬가지로 결정체로는 입방정계 형식의 구슬 모양을 이룬다. 알칼리 금속 중에서는 녹는점과 끓는점이 가장 높고, 제일 단단하기도 하지만, 모스 경도 0.6[13]으로 자르는 것이 여전히 용이하다. 리튬 조각은 나이프로 쉽게 절단할 수 있다. 절단면은 은백색의 금속 광택을 가지나 곧 공기중의 산소와 수증기 따위에 의해 산화되며 검은색으로 변한다. 전도율과 열전도율은 높은 편이다(전도율: 구리의 18% 정도).
리튬에는 마그네슘과 비슷한 점이 있다. 마그네슘은 6각형으로, 리튬은 정육면체 형태로 조합할 때 가장 조밀하지만, 어느 한도까지는 둘을 섞은 고용체(固溶體)를 만들 수 있다.[14] 이런 고용체 내에서는 두 원소 중 수가 더 많은 쪽이 자신의 결정 격자(格子)를 관철시킨다.
리튬 이온은 -520kJ/mol로 알칼리 메탈 중에서 가장 높은 수화 엔탈피를 가지고 있으며, 이로 인해 물 속에선 완전히 수화물이 되어 물 분자를 강하게 끌어들인다. 이때 리튬 이온은 주위에 두 개의 H2O 분자층을 형성하는데, 가까운 층은 4개의 물 분자로 이루어지고, 이 분자층은 수소 결합을 통해 바깥쪽의 다른 분자들과 다시 연결된다. 이렇게 수소화한 리튬 이온의 지름은 질량은 더 높지만, 수소 분자를 이만큼 세게 끌어당기지 않는 루비듐이나 세슘의 수소화 이온보다도 더 커진다.

리튬 원소는 독자적으로 기체 형태로 변할 수 있고, 두 원자가 결합해 이중 리튬(Li2) 형태의 기체를 이룰 수도 있다. 이중 리튬의 결합 길이는 267.3pm이며, 결합 에너지는 101 kJ/mol이다.[15] 기체 상태의 리튬은 질량의 1% 정도가 이중 리튬을 형성한다.
화학적 속성[편집]
리튬은 알칼리 금속 중에서 반응률이 가장 낮음에도 불구하고 여전히 매우 쉽게 반응하고, 열을 발산하면서 다종의 다른 원소들과 화합물을 이룬다. 상온 상태의 완전히 건조한 공기 내에서는 비교적 안정된 편이지만, 습도가 높으면 급격히 수산화 리튬(LiOH) 층을 형성하며, 상온 상태의 건조한 공기 내에서도 다른 알칼리 금속과는 달리 천천히 질소와 반응해 질화 리튬(Li3N)을 형성한다. 물과 접촉하면 급격히 산화한다.
- .
Li+ 이온의 높은 전하 밀도와 그에 비례해 역시 높은 질화 리튬의 격자 에너지에 의해 이 반응이 가능하다. 리튬은 표준 환원 전위는 −3,04 V이며,[16] 이는 모든 원소 중의 최저치를 기록한다.
다른 알칼리 금속과 마찬가지로 공기를 구성하는 산소나 질소와의 반응을 막기 위해 등유 또는 파라핀유에 담구어 보관한다. 유리 앰플 안에 넣어 진공 또는 아르곤 대기 하에 보존할 수 있다. 그러나 다른 알칼리 금속처럼 유리 앰플 안에서 용융시켜 보존할 수 없는데 리튬이 유리를 침식하기 때문이다.
리튬과 마그네슘은 대각 방향 관계(diagonal relationship)를 이루며, 이들의 화합물 들에서도 역시 유사한 점을 발견할 수 있다. Li+와 Mg2+ 이온의 지름은 비슷하다.
리튬은 나트륨과는 달리 부틸 리튬이나 메틸 리튬 등의 여 러 유기 금속 화합물을 이룰 수 있다. 거의 모든 유기리튬화합물은 대기와 격렬히 반응한다. 베릴륨과 알루미늄, 붕소와 규소 사이의 관계도 이와 유사하다.
동위 원소[편집]
자연적으로는 안정된 원자인 6Li(7.6%)와 7Li(92.4%)가 존재하며, 반감기가 밀리초(ms) 범위에 드는 방사성의 다른 동위 원소는 인위적으로만 생산할 수 있다.[17]
6Li는 원자로에서 중수소와의 융합에 필요한 삼중수소의 원료로 쓰인다. 삼중수소는 원자로용 블랭킷(blanket)에서나 또는 수소 폭탄 내에서 헬륨이나 6Li이 중성자로 쏘여 만들어진다.
- .
이외에도
7Li을 이용한 핵반응도 가능하지만, 에너지 한도가 높은 탓으로 안전성 보장이 어려워지기 때문에 주로 쓰이지는 않는다.
6Li는 리튬을 추출할 때부터 이미 핵융합용으로 따로 모으므로, 시중에서 구할 수 있는 리튬은 거의 순수한 7Li이다. 두 동위 원소의 분리는 용해된 리튬 화합물(예로서 에탄올에 용해된 염화 리튬)과 리튬 아말감의 동위 원소 교환을 통해 이룰 수 있다. 이 분리를 통해 얻을 수 있는 6Li의 양은 약 50% 정도이다.[18]
3단계 수소 폭탄 내에 6Li뿐만 아니라 7Li도 포함되어 있을 경우, 이는 핵융합에서 생기는 빠른 중성자들과 반응한다. 이때 7Li는 에너지를 소비하지만, 동시에 만들어지는 또다른 중성자들과 헬륨, 삼중수소 등의 핵융합과 우라늄 핵분열의 증가로 인해 전체적으로 방출하는 에너지는 오히려 높아진다. 이는 1954년, 7Li를 포함한 캐슬 브라보(Castle Bravo)의 폭발력이 예상치의 2.5배에 달했던 것에서 볼 수 있었는데, 이 예상치는 원래 7Li가 중성자와 반응을 일으키지 않을 경우를 가정한 수치였다.[19]
7Li는 원자력 발전소에서 붕소의 동위 원소 중 하나인 10B와 중성자의 핵반응을 통해서도 소량이 생산된다.[20]
6Li과 7Li는 둘 다 차가운 양자 기체(quantum gas)를 이용한 실험에 사용된다. 보스-아인슈타인 응축은 보손 동위 원소 7Li로도 생성할 수 있다.[21]
6Li은 페르미온이며, 근래에 이 동위 원소로 구성된 이중 리튬의 분자를 초유체로 변형하는 것에 성공했다.[22].
용도[편집]
대부분의 생산된 리튬 염은 리튬 자체로 환원되기보다는 곧장 탄산 리튬, 수산화 리튬, 염화 리튬, 브로민화 리튬 등의 다른 리튬 화합물을 만드는 데 쓰인다.
금속[편집]
산출한 리튬 금속의 일부는 탄산 리튬에서 직접 추출할 수 없는 리튬 화합물을 만드는 데 쓰인다. 특히 리튬 유기 화합물인 부틸 리튬이나 리튬과 수소의 화합물인 수소화 리튬(LiH), 수소화 알루미늄 리튬(LiAlH4), 리튬 아미드(LiNH2) 등을 예로 들 수 있다.
리튬 금속은 매우 강한 환원제로, 벤젠 핵(benzol nucleus)에 수소를 첨가하는 버치 환원(Birch reduction)에 쓰인다. 금속 공학에서는 탈산(脫酸)과 황이나 탄소의 제거에 사용된다.
리튬은 질소와 반응하는 성질을 가지고 있기 때문에, 기체에서 질소를 유리하는 데에 사용된다.
환원 전위가 낮아 전지의 양극으로 사용할 수 있다. 이 리튬 전지는 높은 에너지 밀도를 가지고 있으며, 고전압을 일으킬 수 있다. 리튬 전지는 산화 코발트 리튬와 같은 산화 금속 리튬이 음극이 되고, 흑연이나 다른 리튬 이온을 포함한 화합물이 양극을 형성하는 리튬 이온 전지와 혼동할 수가 있다.[23]
합금 성분[편집]
리튬은 몇몇 금속(예를 들어 마그네슘이나 알루미늄)과 함께 합금되며, 적은 양으로도 뜻한 효과를 볼 수 있다. 같이 섞으면 항장력, 강도, 탄력성이 좋아지기 때문이다. 리튬 합금은 아주 가벼워 항공과 우주 비행에도 자주 쓰인다.
원자물리학 연구[편집]
원자물리학에는 리튬이 곧잘 쓰인다. 알칼리 금속 중에서는 유일하게 안정된 페르미온인 6Li는 극저온 상태인 페르미온적 양자 기체의 효과를 연구하는 데에 쓸모가 있다(BCS 이론 참조). 동시에 광범위한 페쉬베이크 공진(Feshbach resonance)을 일으키므로, 흩어놓는 원자의 거리를 마음대로 정할 수 있으며, 자기장이 완벽히 정밀해야 할 필요도 없어진다.
핵융합 원료 물질[편집]
핵융합에는 리튬이 이용된다. kstar와 같이 토카막을 이용한 핵융합에는 중수소와 삼중수를 핵융합시키는데 자연계에는 삼중수가 거의 없다. 이에 6Li을 사용한다. 6Li가 중성자와 반응하면서 헬륨과 삼중수소가 만들어지고 이 삼중수소를 핵융합 연료로 사용한다.
6Li + 1n -> 4He + 3H
3H + 2H -> 4He + 1n
의학[편집]
1850년경에 서구 의학계에선 리튬에 의한 통풍 치료를 시도했으나 이는 효과가 없음이 드러났으며, 이외에도 전염병에 대해 리튬 염을 써 보았으나 역시 성공적이진 못했다.
1949년에 오스트레일리아의 심리학자 존 케이드(John Cade)는 리튬 염을 기니피그에 주사해 보았고, 그 결과 주사를 맞은 동물들은 피곤해지지는 않으나 외부 자극에 덜 민감하게 반응하게 되었다.[24]
리튬을 사용한 자기 실험 후 케이드는 1952~1954년까지 덴마크 리스코프(Risskov)의 어느 병원에서 탄산 리튬을 조울증이나 조현병, 조병을 앓는 환자에게 투여해 보았고[25], 이는 리튬 치료법의 초석을 마련했다.
리튬 치료에서는 탄산 리튬 등의 리튬 염이 위에서 언급한 병들과 클러스터 두통에 대한 약물로 쓰이는데, 이때 리튬의 낮은 치료 지수를 참작해야 한다. 리튬 농도가 너무 높을 경우 진전(振顫), 오한(惡寒), 구역질, 구토, 부정맥(不整脈), 백혈구 증가증 등의 부작용을 낳을 수 있으며, 농도가 0,003 mol/l 이상이 되면 생명이 위험해진다. 리튬과 나트륨은 물질대사에서 비슷한 반응을 보이는데, 땀을 흘리거나 나트륨을 몸에서 걸러내는 약물의 복용에 의해 신체 내의 나트륨 농도가 낮아지면 몸이 이 부족함을 메우기 위해 신장의 비농축뇨(unconcentrated urine)에서 나트륨을 빼어내 혈액에 충당하고, 이때 원래 몸 밖으로 내보내져야 할 리튬도 같이 회수된다. 이 때문에 리튬 투여량를 조절하는 약물 모니터링이 필요해진다.
리튬의 효력이 어떻게 발생하는지는 아직까지 알려져 있지 않다. 21세기 초에는 리튬이 미오이노지트-1-포스타파제(myo-inositol-1-phosphatase, 효소 번호 3.1.3.25)의 억제에 의해 이노지트의 변환에 영향을 주거나[26][27], 신경 세포 내의 GSK-3(Glykogensynthasekinase-3)를 억제하는 점 등으로[28] 리튬의 작용을 설명할 수 있는가에 대한 토론이 진행되고 있다. 우울증에 보이는 효력은 아마도 세로토닌의 신경 전달을 강화하는 데에서 비롯되고, 조병은 도파민 수용체를 억누르기 때문인 것으로 추측된다.[29][30] Eine weitere interessante Auswirkung von Lithiumsalzen auf den Menschen und Säugetiere wie Ratten ist die wohl damit zusammenhängende Veränderung der Circadianen Rhythmik.[31]
리튬 염이 인간이나 다른 포유류, 심지어는 칼랑코에 같은 식물에게까지 끼치는 영향으로는 일주율의 변화를 들 수 있는데,[32][33] 이는 LSD, 메스칼린, 실로사이빈(Psilocybin) 등의 세로토닌적 물질에서도 볼 수 있는 현상이다.[34] 이외에도 리튬은 알츠하이머병에 걸릴 확률을 감소시킨다.[35]
검출 방법[편집]

리튬 화합물을 그을리면 진홍색의 불꽃을 볼 수 있다. 굵은 스펙트럼 선은 670, 776nm와 670, 791nm에, 가는 선은 610.3nm에 놓여 있다. 이외에도 측광법을 사용한 방법도 있다.
대부분의 리튬 염은 물에 잘 녹으므로 액체 내에 포함된 리튬의 양을 구명하는 것은 보통은 쉽지 않다. 여기에 사용할 수 있는 방법의 하나로 수산화 나트륨 등으로 리튬이 용해된 액체를 알칼리성으로 만들고, 인산 수소 나트륨(Na2HPO4)을 첨가한 후 가열하면 비용해성 물질인 인산 리튬이 고체 형태로 드러난다.
위험성[편집]
리튬은 액체인 상태에서 공기와 접촉하거나, 순수한 산소를 100 °C 이상의 온도에서 접하게 될 경우, 또는 금속 먼지(metal dust)로 상온 상태에 놓여 있으면 발화한다. 온도가 190 °C를 넘으면 리튬은 공기와의 접촉으로 대부분이 산화 리튬을 형성하며 그 과정에서 엄청난 양의 열을 방출한다. 주변의 기체가 질소로만 구성되어 있을 경우 온도가 더 높아져야 질화 리튬으로 변한다. 산소나 할로젠을 포함한 물질과는 폭발적인 합성 반응을 일으킬 수 있다. 일반적으로 리튬 조각이 물과 반응하여 발화하기는 상당히 어려운데 이는 수소가 발화할 만큼 충분한 양의 열이 모이기 어렵기 때문이다. 그러나 리본(ribbon)이나 포일(foil), 가루(powder) 상 등 표면적이 넓을 경우에는 불이 붙을 수 있다. 이 경우 리튬은 다른 알칼리금속과 같이 폭발할 수 있다. 진한 염산과 같은 강산과 반응하면 큰 폭발을 일으키며 불타는 용융 리튬 방울이 사방으로 비산한다.
피부에 닿으면 부식에 의한 상처나 화상을 입게 되는데, 이는 리튬이 피부의 수분과 반응해 많은 열을 발산하며 또 강염기성인 수산화 리튬을 형성하기 때문이다. 일반적으로 리튬을 사용하여 실험할 때는 특수한 경우가 아니면 아르곤 대기로 치환시킬 필요는 없다. 그러나 습기가 있는 곳에서 실험하거나 보관할 경우는 리튬이 수분과 반응하여 대단히 위험하다. 보통은 파라핀유나 등유(케로센) 하에서 보관하며 순도가 높은 리튬은 아르곤 대기 하에서 보관한다.
화합물[편집]


리튬은 매우 반응하기 쉽고 대부분의 비금속과 화합물을 이룬다. 이들 화합물의 구조는 보통은 이온적이지만, 다른 알칼리 금속에 비해 공유 결합성이 상당히 높으며, 이는 리튬 염이 나트륨 염이나 칼륨 염과는 달리 아세톤이나 에탄올에 용해하기가 쉽다는 점에서도 엿볼 수 있다. 다수의 리튬 화합물은 마그네슘 화합물과 유사한 특징을 가지고 있다. 그 밖에 리튬 화합물은 의약품으로도 쓰인다.
수소 화합물[편집]
수소와 리튬은 수소화물을 이룬다. 가장 단순한 화합물인 수소화 리튬은 600~700 °C에서 만들어지며, 로켓 연료나 수소로 단시간에 부풀려야 하는 구명 조끼 등에 쓰인다.[4] 수소화 알루미늄 리튬(LiAlH4)은 유기 화학에서 카보닐기나 질소 화합물을 환원할 때 수소 제공 용도로 그 중요성이 높다.
핵융합을 연구하는 데에는 중수소화 리튬(LiD)이나 삼중수소화 리튬(LiT)가 중요한 역할을 하는데, 중수소화 리튬만을 사용하면 수소 폭탄의 에너지가 줄어드므로 삼중수소화 리튬을 같이 섞는다. 이 고체들은 유출 속도(effusion speed)가 높은 삼중 수소보다 통제하기가 쉽다.
산소 화합물[편집]
산소와 리튬은 산화 리튬(Li2O)과 과산화 리튬(Li2O2)을 이룬다.
리튬과 물이 반응할 경우 강한 염기인 수산화 리튬이 만들어지고, 이것으로 자동차에 쓰이는 리튬 지방을 생산할 수 있다. 수산화 리튬은 이산화 탄소를 묶을 수 있기 때문에 잠수함의 공기 재활용에도 쓰인다.
다른 리튬 화합물[편집]
리튬과 할로젠의 화합물로는 플루오린화 리튬(LiF), 염화 리튬(LiCl), 브로민화 리튬(LiBr), 아이오딘화 리튬(LiI) 등이 있다. 염화 리튬은 매우 흡습성이 강하므로 리튬을 유리해낼 때를 빼면 건조제로도 쓰이는데, 예를 들면 천연 가스가 수송관으로 들여보내지기 전이나 냉난방 시설로 공기 중의 습도를 낮출 때 등이며, 이외에도 알루미늄을 용접할 때 용접 전극의 외피로도 사용된다. 수용액 상태의 염화 리튬은 철을 급속도로 부식시키기에 주의해야 한다. 플루오린화 리튬은 단일 결정체로 적외선 분광학에서 사용된다.
기술적으로 가장 중요한 화합물은 비용해성 물질인 탄산 리튬으로, 다른 리튬 화합물의 원료나 유리 공업, 또는 에나멜을 제조할 때의 용제(溶劑)로 사용된다. 알루미늄을 제조할 때는 전도율과 점성(粘性)을 높이기 위해 용액에 첨가된다. 또한 의약품 수준으로 정제하여 의약품으로 쓰인다. 현재 대한민국 식품의약품안전처에 허가된 리튬제제는 모두 탄산리튬 제제이다.
이외의 리튬 화합물로는:
- 과염소산 리튬(LiClO4),
- 황산 리튬(Li2SO4),
- 질산 리튬(LiNO3)은 질산 칼륨과 함께 고무의 경화(硬化)에 쓰인다.
- 질화 리튬(Li3N),
- 나이오븀산 리튬(LiNbO3)은 상당 부분의 파장 범위 내에서 투명하며 광학과 레이저에 쓰인다.
- 리튬 아미드(LiNH2)은 강한 염기로 리튬과 액화 암모니아의 반응에서 생성된다.
- 스테아린산 리튬(C18H35O2Li)은 자동차, 압연로나 농기계에 바르는 기름의 중요한 부가물이다. 스테아린산 리튬은 물에 매우 어렵게 녹으므로 이것이 포함된 기름은 소량의 물 정도에는 씻기지 않는다. 이런 기름으로 작업하는 것은 −20 °C에서 150 °C까지 가능하다.[36]
유기 리튬 화합물[편집]
다른 알칼리 금속과는 달리 유기 리튬 화합물은 특히 유기 화학 분야에서 꽤나 큰 비중을 차지한다. n-부틸리튬, tert-부틸리튬, 메틸리튬, 페닐리튬이 중요하며, 이들은 펜테인, 헥세인, 사이클로헥세인과 경우에 따라선 다이에틸에테르에 용해된 상태로 구입하는 것이 가능하다. 이들을 리튬 금속과 알킬/아릴할로젠 화합물을 반응하게 하거나
유기 수은 화합물 등의 transmetallation을 통해 직접 생산할 수 있다.
유기 리튬 화합물은 대부분 2, 3, 6량체나 중합체적 구조를 유지하며, 반응력이 높다. 이 중 일부는 공기와 닿으면 당장 발화하고, 물과는 폭발적으로 반응한다. 높은 염기도로 인해 수소의 산성이 낮은 용매(예를 들어 테트라하이드로퓨란, C4H8O)와도 반응할 수 있으므로, 적합한 용매의 양은 아주 제한되어 있다. 이들의 반응은 보호 가스 내에서 건조한 용매를 사용해 이루어져야 하며, 경험과 주의가 필요하다.
다른 유기 리튬 화합물로는 리튬 아미드의 일종인 LiNR2가 있으며, 그중에서도 특히 리튬 다이이소프로필아미드(Lithium Diisopropylamide, LDA)와 리튬 비스(트리메틸실릴)아민(Lithium Bis(trimethylsilyl)amine, LiHMDS)이 비구핵성의 강한 염기로 이용된다.
양성자 제거, 알킬화나 알켄을 음이온 중합할 때의 개시제로도 쓰인다.
유기 동화합물의 하나인 R2CuLi도 나름대로 의미가 있다.
한국의 리튬 광산[편집]
울진 보암광산, 울진 리튬광산은 울진군 서면 왕피리 일대에 발달하는 리튬 광상이다. 변성퇴적암류로는 원남층(준편마암), 그 위에 정합으로놓이는 동수곡층과 장군 석회암층, 율리층군과 이를 관입한 왕피리화강편마암으로 구성되며 리튬광상은 장군석회암층의 중앙부를 층리면에 나란하게 관입한 길이 약 1 km의 희유원소 페그마타이트(rare-element pegmatite) 및 그 연변부에 발달한 홍운모-엘바이트 영운암으로 구성된다. 리튬의 함량은 서부광체가 1130~1584 ppm, 본-부본광체(main-submain orebody)가 589~5280 ppm, 동부광체가 4474 ppm이다.[37]
울진군 서면 왕피리 일대에서는 1945~1963년에 고품위 리튬 광석이 채굴되었으며, 저품위 광체는 Li2O 평균함량이 1.69%, 고품위 광체는 3% 를 함유하는 것으로 보고되었다. 선캄브리아기의 장군석회암내에 배태된 보암 리튬광상은 각력상으로 산출되는 리튬광체와 페그마타이트-반화강암 맥을 따라 산출되는 맥상 리튬광체로 이루어져 있다. 각력상 리튬광체와 맥상 리튬광체 모두 석영과 리튬 운모인 레피돌라이트(lepidolite)에 함유된다. 각력상 광석과 맥상 광석의 Li2O 함량은 각각 평균 4.70 wt.%와 1.88 wt.% 로 각력상 리튬광체가 더 많은 리튬을 함유하고 있다. 리튬 운모인 레피돌라이트에 대한 K-Ar 연령 측정 결과 각력상 리튬광석으로부터 분리한 레피돌라이트는 169.3~160.1 Ma, 맥상 리튬광석에서 분리한 레피돌라이트는 160.8~154.6 Ma 로 리튬 광화 작용은 주로 쥬라기 중기에서 말기 동안에 일어난 것을 알 수 있다.[38]
같이 보기[편집]
각주[편집]
- ↑ C. Elschenbroich: Organometallchemie. 5. Auflage. Teubner, 2005, S. 16.
- ↑ 가 나 Kogel, Jessica Elzea (2006). 〈Lithium〉. 《Industrial minerals & rocks: commodities, markets, and uses》. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. 599쪽. ISBN 978-0-87335-233-8. 2020년 11월 7일에 원본 문서에서 보존된 문서. 2020년 11월 6일에 확인함.
- ↑ United States Geological Survey: Minerals Yearbook 2007: Lithium, 2007.
- ↑ 가 나 dtv-Atlas Chemie. Band 1. dtv, 2000.
- ↑ 가 나 Lithium bei USGS Mineral Resources, 2009.
- ↑ Simon Romero: In Bolivia, Untapped Bounty Meets Nationalism. Auf: nytimes.com. 2. Feb. 2009 (뉴욕 타임스의 볼리비아 리튬 채취장에 대한 보도).
- ↑ 한국지질자원연구원, 리튬 추출ㆍCO₂처분 기술 상용화 주도 [디지털시대 경제신문 디지털타임스]
- ↑ 리튬은 다 어디로 갔는가 Archived 2006년 8월 29일 - 웨이백 머신. wissenschaft.de (Beobachtung eines fernen Sternsystems bringt die Lösung eines Kosmologie|kosmologischen Rätsels).
- ↑ 갈색 왜성에 대해.
- ↑ Garik Israelian, Elisa Delgado Mena, Nuno C. Santos, Sergio G. Sousa, Michel Mayor, Stephane Udry, Carolina Domínguez Cerdena, Rafael Rebolo, Sofia Randich: Enhanced lithium depletion in Sun-like stars with orbiting planets. In: Nature. 2009, 462, S. 189-191.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente in: Acta Crystallographica 30, 1974, S. 193–204.
- ↑ 가 나 Arnold F. Holleman, Egon Wiberg, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100. Auflage. de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 928–931.
- ↑ webelements.com에 나온 리튬의 물리학적 속성
- ↑ Malissa, H. (1959). “Die Trennung des Lithiums vom Magnesium in Lithium-Magnesium-Legierungen”. 《Fresenius' Journal of Analytical Chemistry》 171 (4). ISSN 0937-0633..
- ↑ Mark J. Winter: Chemical Bonding. Oxford University Press, 1994, ISBN 0-19-855694-2.
- ↑ M. Binnewies: Allgemeine und Anorganische Chemie. Spektrum Verlag, 2006, S. 241.
- ↑ The Nubase evaluation of nuclear and decay properties Archived 2008년 9월 23일 - 웨이백 머신 (PDF, 영어)
- ↑ R. Bauer: Lithium-wie es nicht im Lexikon steht. Chemie in unserer Zeit 19, Nr. 5, 1985, S. 167–173.
- ↑ 핵실험 캐슬 브라보에 대한 보도 (영어)
- ↑ Martin Volkmer: Kernenergie Basiswissen. Inforum, 2007, ISBN 3-926956-44-5, S. 39 (PDF Archived 2009년 1월 27일 - 웨이백 머신).
- ↑ C. C. Bradley, C. A. Sackett, J. J. Tollett, R. G. Hulet: Evidence of Bose-Einstein Condensation in an Atomic Gas with Attractive Interactions. In: Physical Review Letters 75, Nr. 9, 1995, S. 1687–1690, PDF[깨진 링크(과거 내용 찾기)]).
- ↑ S. Jochim, M. Bartenstein, A. Altmeyer, G. Hendl, S. Riedl, C. Chin, J. Hecker Denschlag, R. Grimm: Bose-Einstein Condensation of Molecules. In: Science. 302, Nr. 5653, 2003, S. 2101–2103, vgl. Selim Jochim의 학위 논문[깨진 링크(과거 내용 찾기)]).
- ↑ 그라츠 공업 대학의 전지에 관한 논문 Archived 2009년 1월 24일 - 웨이백 머신. (PDF)
- ↑ J. Cade: Lithium salts in the treatment of psychotic excitement. In: Med. J. Australia 36, 1949, S. 349.
- ↑ M. Schou: Lithiumbehandlung der manisch-depressiven Krankheit. Thieme, 2001, ISBN 3-13-593304-0.
- ↑ M. J. Berridge: Inositol trisphosphate and diacylglycerol as second messengers. In: Biochemical Journal 220, Nr. 2, 1984, S. 345–360 (Abstract).
- ↑ D. H. Carney, D. L. Scott, E. A. Gordon, E. F. LaBelle: Phosphoinositides in mitogenesis: neomycin inhibits thrombin-stimulated phosphoinositide turnover and initiation of cell proliferation. In:Cell 42, Nr. 2, 1985, S. 479–488 (Abstract).
- ↑ R. Williams, W. J. Ryves, E. C. Dalton, B. Eickholt, G. Shaltiel, G. Agam, A. J. Harwood: A molecular cell biology of lithium. In: Biochem. Soc. Trans. 32, 2004, S. 799–802.
- ↑ 향정신성 약물치료
- ↑ B. Woggon: Behandlung mit Psychopharmaka. Huber, Bern 1998, S. 77–84.
- ↑ T. Hafen, F. Wollnik: Effect of lithium carbonate on activity level and circadian period in different strains of rats. In: Pharmacology Biochemistry & Behavior. 49, 1994, S. 975–983.
- ↑ E. Bünning, I. Moser: Influence of Valinomycin on Circadian Lead Movements of Phaseolus. In: Prod. Nat. Acad. Sci. USA 69, Nr. 9, 1972, S. 2733 ([http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=427027&blobtype=pdf PDF).
- ↑ W. Engelmann: Lithium slows down the Kalanchoe clock. In: Z. Naturforsch. 27, 1972, S. 477.
- ↑ 환각제 열람 Archived 2012년 1월 17일 - 웨이백 머신.
- ↑ 알츠하이머병: 리튬을 통한 새로운 희망 Archived 2009년 9월 16일 - 웨이백 머신. Medizinauskunft.de:, 29. Juli 2004.
- ↑ 주기율표: 리튬 Archived 2007년 5월 25일 - 웨이백 머신. Uniterra.de.
- ↑ Oh, Il Hwan; Yang, Seok Jun; Heo, Chul Ho; Lee, Jae Ho; Kim, Eui Jun (2022년). “Study on the Controlling Factors of Li-Bearing Pegmatite Intrusions for Mineral Exploration, Uljin, South Korea”. 《Minerals》 12 (5): 589. doi:10.3390/min12050589.
- ↑ 최윤호; 박영록; 노진환 (2014년 8월). “Genesis of Boam lithium deposits in Wangpiri, Uljin (울진 왕피리 보암 리튬광상의 성인)”. 《대한지질학회》 50 (4): 489-500. doi:10.14770/jgsk.2014.50.4.489.
외부 링크[편집]
- “리튬”. 《네이버캐스트》.
- (독일어) 알칼리 금속의 요약 (PDF; 2,20 MB)
- (영어) 로스앨러모스 국립 연구소의 리튬 설명 Archived 2008년 12월 23일 - 웨이백 머신
- (영어) 리튬 - WebElements.com
- (영어) 리튬 - EnvironmentalChemistry.com[깨진 링크(과거 내용 찾기)]






![{\displaystyle \mathrm {Li^{+}+e^{-}\ {\xrightarrow[{electrolyte}]{352^{\circ }C}}\ Li} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/853f8be89a8b71b14e0663dca442903ab8f1e549)
![{\displaystyle \mathrm {KCl+LiCl\ {\xrightarrow[{electrolyte}]{352^{\circ }C}}\ K+Li+Cl_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7ffab95fbf0dd4f9bddbbfe5024e8425960415c0)






