Voltammetri

Voltammetri er en kategori av elektroanalytiske metoder som brukes i analytisk kjemi og ulike industrielle prosesser. I voltammetri oppnås informasjon om en analytt ved å måle strømmen ettersom potensialet varieres.[1][2] De analytiske dataene for et voltammetrisk eksperiment kommer i form av et voltammogram som plotter strømmen som produseres av analytten kontra potensialet til arbeidselektroden.[3]
Tre-elektrodesystem[rediger | rediger kilde]

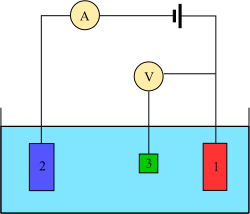
Voltammetri-eksperimenter undersøker halvcellereaktiviteten til en analyt. Voltammetri er studiet av strøm som en funksjon av anvendt potensial. Disse kurvene I=f(E) kalles voltammogrammer. Potensialet varieres vilkårlig enten trinnvis eller kontinuerlig, og den aktuelle strømverdien måles som den avhengige variabelen. Det motsatte, dvs. amperometri, er også mulig, men ikke vanlig. Formen på kurvene avhenger av hastigheten på potensiell variasjon (drivkraftens natur) og av om løsningen blir rørt eller ikke (masseoverføring). De fleste eksperimenter kontrollerer potensialet (volt) til en elektrode i kontakt med analytten mens de måler den resulterende strømmen (ampere).[4]
For å gjennomføre et slikt eksperiment krever man minst to elektroder. Arbeidselektroden, som tar kontakt med analytten, må bruke ønsket potensial på en kontrollert måte og lette overføringen av ladning til og fra analytten. Den andre elektrode fungerer som den andre halvdelen av cellen. Denne andre elektroden må ha et kjent potensial for å måle potensialet til arbeidselektroden; Videre må den balansere ladningen som er lagt til eller fjernet av arbeidselektroden. Selv om dette er et levedyktig oppsett, har det en rekke mangler. Mest viktig er det at det er ekstremt vanskelig for en elektrode å opprettholde et konstant potensial mens det går strøm igjennom for å motvirke redokshendelser ved arbeidselektroden.
For å løse dette problemet er rollene som tilfører elektroner og gir et referansepotensial delt mellom to separate elektroder. Referanseelektroden er en halvcelle med et kjent reduksjonspotensial. Dens eneste rolle er å fungere som referanse når det gjelder å måle og kontrollere potensialet til arbeidselektroden, og på intet tidspunkt passerer den strøm. Hjelpeelektroden passerer all strøm som trengs for å balansere strømmen som observeres ved arbeidselektroden. For å oppnå denne strømmen vil hjelpeelektroden ofte svinge til ekstreme potensialer i kantene av løsningsmiddelvinduet, der det oksiderer eller reduserer løsningsmidlet eller støtteelektrolytten. Disse elektrodene, arbeid, referanse og hjelpe utgjør det moderne treelektrodesystemet.
Det er mange systemer som har flere elektroder, men utformingsprinsippene er generelt de samme som for tre-elektrodesystemet. For eksempel har den roterende ring-skive-elektroden to distinkte og separate arbeidselektroder, en skive og en ring, som kan brukes til å skanne eller holde potensialer uavhengig av hverandre. Begge disse elektrodene balanseres av en enkelt referanse og hjelpekombinasjon for en samlet fire-elektrodesign. Mer kompliserte eksperimenter kan legge til arbeidselektroder etter behov og til tider referanse- eller hjelpelektroder.
I praksis kan det være viktig å ha en arbeidselektrode med kjente dimensjoner og overflateegenskaper. Som et resultat er det vanlig å rengjøre og polere arbeidselektroder regelmessig. Hjelpelektroden kan være nesten hva som helst så lenge den ikke reagerer med hoveddelen av analytløsningen og leder godt. Det var vanlig å bruke kvikksølv som arbeidselektrode f.eks. DME (dryppende kvikksølvelektrode) og HMDE (hengende kvikksølvdråpeelektrode), og også som hjelpemiddel, og voltammetri-metoden er da kjent som polarografi. Referansen er den mest komplekse av de tre elektrodene; det er en rekke standarder som brukes, og det er verdt å undersøke andre steder. For ikke-vandig arbeid anbefaler IUPAC bruk av ferrocen/ferrocenium-paret som en intern standard.[5] I de fleste voltammetrieksperimenter brukes en bulkelektrolytt (også kjent som en støtte elektrolytt) for å minimere løsningsmotstand. Det er mulig å kjøre et eksperiment uten masselektrolytt, men den ekstra motstanden reduserer nøyaktigheten av resultatene. Med ioniske væsker ved romtemperatur kan løsningsmidlet fungere som elektrolytt.
Teori[rediger | rediger kilde]
Dataanalyse krever hensyn til kinetikk i tillegg til termodynamikk, på grunn av den temporale komponenten av voltammetri. Idealiserte teoretiske elektrokjemiske termodynamiske forhold som Nernst-ligningen er modellert uten en tidskomponent. Selv om disse modellene ikke er tilstrekkelige alene for å beskrive de dynamiske aspektene ved voltammetri, legger modeller som Tafel-ligningen og Butler-Volmer ligningen grunnlaget for de modifiserte voltammetri-forholdene som relaterer teori til observerte resultater.[6]
Applikasjoner[rediger | rediger kilde]
Voltammetriske sensorer[rediger | rediger kilde]
En rekke voltammetriske systemer produseres kommersielt for bestemmelse av spesifikke specier som er av interesse for industri og forskning. Disse enhetene kalles noen ganger elektroder, men er faktisk komplette voltametriske celler og blir bedre referert til som sensorer. Disse sensorene kan brukes til analyse av ulike organiske og uorganiske analyser i forskjellige matriser.[7]
Oksygenelektroden[rediger | rediger kilde]
Bestemmelsen av oppløst oksygen i en rekke vandige miljøer, som sjøvann, blod, kloakk, avløp fra kjemiske planter og jord er av enorm betydning for industri, biomedisinsk og miljøforskning og klinisk medisin. En av de vanligste og mest praktiske metodene for å gjøre slike målinger er med Clark oksygensensor, som ble patentert av L.C. Clark, Jr. i 1956.
Referanser[rediger | rediger kilde]
- ^ Laboratory techniques in electroanalytical chemistry (2nd ed., rev. and expanded utg.). New York: Marcel Dekker, Inc. 1996. ISBN 0-8247-9445-1. OCLC 33359917.
- ^ Handbook of electrochemistry (1st ed utg.). Amsterdam: Elsevier. 2007. ISBN 978-0-08-046930-0. OCLC 162129983.
- ^ Harris, Daniel C. (2016). Quantitative chemical analysis (Ninth edition utg.). New York. ISBN 978-1-4641-3538-5. OCLC 915084423.
- ^ Bard, Allen J. (2001). Electrochemical methods : fundamentals and applications (Second edition utg.). Hoboken, NJ. ISBN 0-471-04372-9. OCLC 43859504.
- ^ Gritzner, G.; Kuta, J. (1. januar 1984). «Recommendations on reporting electrode potentials in nonaqueous solvents (Recommendations 1983)». Pure and Applied Chemistry. 4. 56: 461–466. ISSN 1365-3075. doi:10.1351/pac198456040461. Besøkt 9. mars 2021.
- ^ Nicholson, R. S.; Shain, Irving. (1. april 1964). «Theory of Stationary Electrode Polarography. Single Scan and Cyclic Methods Applied to Reversible, Irreversible, and Kinetic Systems.». Analytical Chemistry. 4 (engelsk). 36: 706–723. ISSN 0003-2700. doi:10.1021/ac60210a007. Besøkt 9. mars 2021.
- ^ Sanghavi, Bankim J.; Srivastava, Ashwini K. (Desember 2010). «Simultaneous voltammetric determination of acetaminophen, aspirin and caffeine using an in situ surfactant-modified multiwalled carbon nanotube paste electrode». Electrochimica Acta. 28 (engelsk). 55: 8638–8648. doi:10.1016/j.electacta.2010.07.093. Besøkt 9. mars 2021.
